
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состав продуктов горения
|
|
|
|
Состав продуктов горения горючего вещества определяется:
– термическими условиями в горючей системе (температурой и давлением);
– соотношением количеств горючего и окислителя;
– условиями теплового взаимодействия горючей системы с окружающей средой;
– интенсивностью физико-химических процессов в горючей системе.
Для расчёта состава продуктов горения составляется система уравнений, в которую входят уравнения материальных балансов химических элементов, участвующих во взаимодействиях при горении, и уравнения констант равновесия или констант скоростей химических реакций. В общем случае система уравнений отличается повышенной сложностью. Решение задачи в указанной постановке получено лишь для частных случаев, например для стехиометрически полного горения.
3.3.1. Расчёт стехиометрически полного горения смеси газообразных веществ
Предварительно известны:
– исходный состав смеси в процентах по объёму
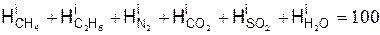 ;
;
- коэффициент расхода воздуха – a =1
- стехиометрический расход воздуха – L1.
Расчёт проводится на 1 м3. В продуктах сгорания будут находиться:
1. Двуокись углерода, м3/м3,
а) от сгорания СН4

 .
.
б) от сгорания С2Н6

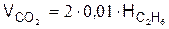 .
.
в) из газовой смеси

г) в сумме

2. Водяной пар, м3/м3,
а) от сгорания СН4

 .
.
б) от сгорания С2Н6

 .
.
в) из газовой смеси

г) в сумме

3.Сернистый ангидрид, м3/м3,
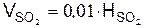
4. Азот, м3/м3,
а) из газовой смеси
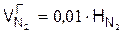 ,
,
б) из воздуха

в) в сумме
 .
.
5. Удельное количество продуктов горения, м3/м3,
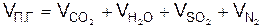
6. Процентный состав продуктов горения, %,
 и т.д.
и т.д.
3.3.2. Расчёт стехиометрически полного горения вещества сложного состава
Предварительно известны:
- исходная масса горючего вещества сложного состава в процентах
 ;
;
- коэффициент расхода воздуха – a =1
- стехиометрический расход воздуха – L1.
Расчёт проводится на 1 кг. В продуктах сгорания будут находиться:
1. Двуокись углерода, м3/кг,
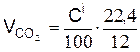 .
.
2. Водяной пар, м3/кг,
а) от сгорания водорода
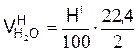 ,
,
б) от испарения влаги горючего вещества сложного состава
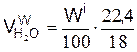 ,
,
в) в сумме

3.Сернистый ангидрид, м3/кг,
 ,
,
4. Азот, м3/кг,
а) из горючего вещества сложного состава
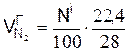 ,
,
б) из воздуха

в) в сумме
 .
.
5. Удельное количество продуктов горения, м3/кг,
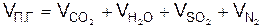
6. Процентный состав продуктов горения, %,
 и т.д.
и т.д.
Методика расчёта стехиометрически полного горения является приближённой, так как не учитывает кинетики физико-химических процессов в горючей системе.
4. Тепловой баланс и адиабатическая температура горения.
Тепловые условия в горючей системе описываются посредством пространственно-временных значений температур, называемых температурными полями. Вычисление этих температур представляет собой сложную и не всегда разрешимую задачу. Наиболее простой тепловой характеристикой горючей системы может служить адиабатическая температура горения.
Уравнение теплового баланса адиабатически изолированной горючей системы стехиометрического состава, слагаемые которой отнесены к единичному количеству горючего вещества, имеет вид

где iГ – энтальпия горючего вещества; iВ – энтальпия воздуха; L1 – удельный стехиометрический расход воздуха; iП.Г – энтальпия продуктов горения; VП.Г – удельное количество продуктов горения; QH – низшая теплота сгорания.
Энтальпия компонентов горючей системы определяется по формуле
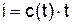 ,
,
где t – средняя температура компонента горючей системы, взятая при постоянном давлении в системе; с(t) – теплоёмкость компонента горючей системы, как функция средней температуры.
Преобразование уравнения теплового баланса относительно температуры продуктов горения приводит к следующему выражению для адиабатической температуры
 .
.
Адиабатической температурой горения называется средняя температура продуктов стехиометрически полного горения, получаемая из уравнения теплового баланса горючей системы при условии, что вся энергия исходных компонентов преобразована в тепловую энергию продуктов горения.
Если принять, что iГ = 0 и iВ = 0, то получим выражение для нормальной адиабатической температуры горения
 .
.
При определении численного значения адиабатической температуры горения необходимо использовать метод итераций.
Из уравнения теплового баланса можно получить выражение для вычисления энтальпии продуктов горения
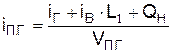 .
.
Задаваясь численными значениями температур, находят такие значения энтальпии продуктов горения
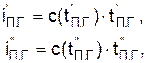
при которых выполняется условие
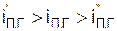 .
.
В принятом для расчёта интервале температур значение адиабатической температуры горения определяется по интерполяционной формуле
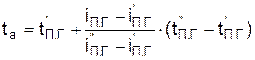 .
.
Для горючей системы нестехиометрического состава, обменивающейся тепловой энергией с окружающей средой, средняя температура горения представляется следующим выражением
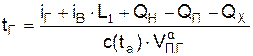 .
.
где QП – потери тепловой энергии из горючей системы в окружающую среду; QХ – химический недожог, вызванный нестехиометричностью горения; VaП.Г – удельное количество продуктов горения при нестехиометрических условиях горения.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2751; Нарушение авторских прав?; Мы поможем в написании вашей работы!