
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Краткая теория химических источников тока
|
|
|
|
Термодинамика электрохимических элементов позволяет определить их электродвижущую силу E (ЭДС). ЭДС – это теоретическая разность потенциалов между положительным и отрицательным электродами в отсутствие тока, т.е. когда элемент разомкнут. ЭДС однозначно связана с изменением энергии Гиббса токообразующей реакции
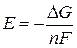
F = 96485 Кл/моль – число Фарадея, n – число электронов, участвующих в токобразующей реакции (для вышеприведенной реакций n = 2).
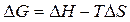
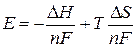
Температурный коэффициент ЭДС связан с изменением энтропии реакции
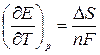
ЭДС равна разности равновесных электродных потенциалов двух электродов
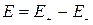
Равновесный электродный потенциал зависит от природы электродной реакции, температуры и активностей растворенных или газообразных веществ в соответствии с уравнением Нернста для окислительно-восстановительной реакции

Например, для полуреакции на цинковом электроде равновесный потенциал равен
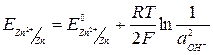
Реальная разность потенциалов электродов разомкнутого элемента, называемая напряжением разомкнутой цепи (НРЦ), может быть равна ЭДС, а может отличаться. Отличие обусловлено тем, что на электродах не устанавливаются равновесные потенциалы из-за протекания других (побочных) реакций, кроме основной реакции, для которой был проведен термодинамический расчет. Побочные реакции типично вредны, т.к. вызывают дополнительный расход реагентов и снижают напряжение элемента.
При подключении элемента к устройству нагрузки, т.е. при его замыкании на внешнюю нагрузку, образуется электрическая цепь
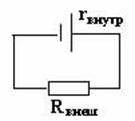
При этом напряжение изменяется, и изменяется тем в большей степени, чем больше сила тока, протекающего через элемент
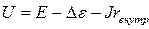
где U – напряжение элемента, ∆e – поляризация элемента, J (или I)– сила тока, r внутр – внутреннее сопротивление элемента. Таким образом, рабочее напряжение ХИТ всегда меньше, чем его ЭДС.
Поляризация ∆e может состоять в общем случае из электрохимической, химической и концентрационной составляющих:

Электрохимическая поляризация ∆eэл обусловлена замедленностью собственно электрохимической реакции. Концентрационная поляризация eконц вызывается замедленностью стадий подвода реагентов к электродам и отвода продуктов реакции. Химическая поляризация eхим возникает, если электродный процесс сложный и включает химические стадии. Общий путь снижения всех составляющих поляризации и повышения таким образом напряжения ХИТ – увеличение удельной поверхности электродов, увеличение температуры и концентрации реагентов, применение каталитически активных электродов.
Графическое изображение зависимости напряжения ХИТ от силы тока называется вольтамперной кривой или вольтамперной характеристикой (ВАХ). Кривая обычно имеет три участка: I и III – участки резкого изменения напряжения, II – участок примерно линейного изменения напряжения, как показано на рисунке. Аналитические формулы, описывающие ВАХ, весьма сложны.
В процессе работы ХИТ, т.е. в процессе его разряда возрастает поляризация элемента и уменьшается ЭДС (не всегда) из-за уменьшения концентрации исходных веществ и увеличения концентрации продуктов реакции (по уравнению Нернста). Обычно также растет и внутреннее сопротивление. По этим причинам наблюдается неуклонное падение напряжения ХИТ во времени по мере разряда. Это наиболее типичное поведение, хотя бывают и исключения: начальный этап разряда может сопровождаться ростом напряжения ХИТ в основном из-за перераспределения составляющих поляризации и/или нагрева. Кривая изменения напряжения во времени называется разрядной кривой (разрядной характеристикой).
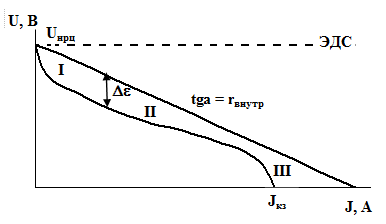
Типичная вольтамперная характеристика ХИТ (схематично).
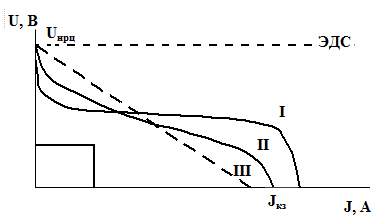
Типичные формы разрядной характеристики ХИТ (схематично).
Разрядные кривые имеют разнообразный вид. До сих пор нет общепринятых теоретических уравнений разрядной кривой. Их характерные формы показаны на рисунке, в том числе I – плоская, II – пологая, III – линейная разрядная характеристика. Идеальная разрядная характеристика также приведена на рисунке, она имеет форму прямоугольника, т.е. весь разряд происходит строго при одном постоянном напряжении и резко заканчивается при 100%-ном исчерпании активных веществ в электродах. Постоянство вырабатываемого напряжения – вот что требуют потребители от ХИТ. Наиболее близка к такой форме плоская разрядная кривая, характеризуемая выраженным плато – рабочим напряжением, при котором происходит основная фаза разряда. Рабочее напряжение всегда меньше ЭДС и может быть неопределенным (когда разрядная характеристика близка к линейной).
Кроме ЭДС, напряжения, ВАХ и разрядной кривой для характеристики электрохимических систем и конкретных типов ХИТ используют следующие параметры: мощность P, удельная мощность P уд, емкость Q, удельная емкость Q уд, энергия W и удельная энергия W уд. Мощность равна произведению силы тока на напряжение  и измеряется в Ваттах:
и измеряется в Ваттах:
1 Ватт = 1 Ампер × 1 Вольт = 1 Кулон × 1 Вольт / 1 сек = 1 Джоуль / 1 сек
Для измерения Q и W обычно применяются внесистемные единицы:
- емкость измеряют в Ампер∙часах (А·ч). 1 А·ч = 1 А × 3600 сек = 3600 Кл;
- энергию измеряют в Ватт∙часах (Вт·ч). 1 Вт·ч = 1 Вт × 3600 сек = 3600 Дж.
Удельная мощность определяется формулой
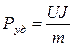 [Вт/кг] или
[Вт/кг] или  [Вт/л]
[Вт/л]
Все факторы, увеличивающие напряжение, приводят к повышению мощности ХИТ. Так как с увеличением тока напряжение элемента падает вплоть до нуля, мощность проходит через максимум при некотором среднем значении силы тока

Емкость ХИТ – наиболее широко используемая характеристика ХИТ. Емкостью называют количество электричества (заряд), которое ХИТ способен выработать при разряде. Теоретическая емкость определяется по закону Фарадея
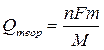 [Кл] или [А·ч]
[Кл] или [А·ч]
Фактическая емкость равна теоретической или ниже из-за неполного использования активных веществ и расхода их на побочные процессы. Фактическая емкость может быть измерена путем полного разряда ХИТ постоянным током J в течение времени t и рассчитана по формуле
 [А·ч]
[А·ч]
Удельная емкость измеряется в А·ч/г или в А·ч/л.
При разряде ХИТ на постоянную нагрузку (на постоянное внешнее сопротивление R) ток непрерывно меняется во времени. В этом случае емкость (заряд) определяется интегрированием произведения J · t и представляет собой площадь под разрядной кривой
 [Кл] или [А·ч]
[Кл] или [А·ч]
где U cp – среднее разрядное напряжение, определяемое усреднением всех точек разрядной кривойц. Обычно на гальваническом элементе или аккумуляторе указывается его рабочее напряжение (иногда также емкость). Так, емкость стартерных свинцовых аккумуляторов чаще всего составляет 40 – 60 А·ч.
Энергия W, которую вырабатывает ХИТ (т.е. энергия, которую он передает во внешнюю нагрузку, полезная энергия, энергозапас), равна произведению емкости на напряжение. Если бы электрохимические реакции в ХИТ протекали термодинамически обратимо, то теоретическая энергия была бы точно равна полезной работе ΔG. Фактически количество вырабатываемой энергии, конечно, меньше ΔG. Энергия определяется площадью под разрядной кривой. При разряде постоянным токам J
 [Дж] или [Вт·ч]
[Дж] или [Вт·ч]
При разряде на постоянную внешнюю нагрузку R ток непрерывно меняется во времени. Преобразуем формулу, используя закон Ома 
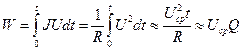 [Дж] или [Вт·ч]
[Дж] или [Вт·ч]
Необходимо четко понимать, что напряжение и ЭДС – всё, что измеряется в Вольтах, – являются интенсивными характеристиками, зависящими от внутренних свойств веществ, от их природы, но не от их количества. Поэтому ХИТ одной и той же электрохимической системы будут иметь одно и то же напряжение, независимо от массы и геометрических размеров ХИТ. Напротив, P, W и Q – экстенсивные характеристики, пропорциональные количеству заложенных реагентов, следовательно, примерно пропорциональные массе или объему ХИТ. Для сравнения различных электрохимических систем используют удельную емкость
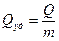 [А·ч/кг] или
[А·ч/кг] или  [А·ч/л]
[А·ч/л]
и удельную энергию (удельный энергозапас)
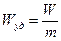 [Вт·ч/кг] или
[Вт·ч/кг] или  [Вт·ч/л]
[Вт·ч/л]
Хотя энергия (энергозапас) W важнее, чем емкость (заряд) Q, последняя употребляется чаще, поскольку 1) емкость легче измерить; 2) энергия сильно зависит от режима разряда, емкость зависит от него в меньшей степени.

Разрядную кривую можно представить как зависимость напряжения U от времени разряда t, обязательно указывая ток разряда I, а можно представлять в координатах U – Q. В этом случае кривая будет более универсальна, т.к. по идее одна и та же кривая должна получаться при разных токах. На самом деле вырабатываемая емкость тоже зависит от тока, типичный характер зависимости показан на рисунке. Обычно чем ближе режим разряда к равновесному, чем меньше ток и чем длительнее разряд, тем выше емкость и особенно энергия.
Таким образом, по мере увеличения силы разрядного тока снижаются напряжение ХИТ и его фактическая емкость. Поэтому емкость, указанная в документах на ХИТ (или в маркировке на его корпусе), – это номинальная емкость С или С° (в А·час), относящаяся к номинальному режиму разряда, т.е. рекомендованному режиму разряда, такому, какой должен быть.
Предпринимались многочисленные попытки установить зависимость между фактической емкостью ХИТ и током разряда. Предложено много эмпирических уравнений, наиболее известна формула Пейкерта (1897 год)
 ,
,
где 0.2<α<0.7. Однако параметры Q 0 и α зависят не только от типа ХИТ, но и от множества других факторов (например, температуры). Поэтому экстраполяция этой формулы за пределы изученного диапазона недопустима. С практической точки зрения идеально было бы, чтобы емкость вообще не зависела от тока, т.е. чтобы α = 0.
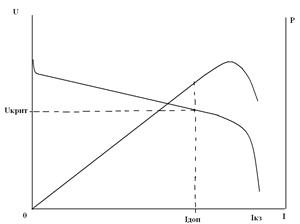
Важной характеристикой любого ХИТ является максимально допустимый ток разряда и связанные с ним максимально допустимая мощность и критическое напряжение. Эксплуатация ХИТ при б о льших токах невозможна или нецелесообразна (например, из-за сильного снижения напряжения или из-за сильного разогрева). Кроме того используется понятие тока короткого замыкания I КЗ. Как показано на рисунке, это наибольший ток, который способен генерировать гальванический элемент (когда внешнее сопротивление равно нулю). Поскольку току короткого замыкания соответствует нулевое напряжение U = 0, следовательно, ему соответствует также нулевая отдаваемая мощность P = 0. В этом режиме вся химическая энергия токообразующей реакции превращается в тепло внутри ХИТ.
Для перезаряжаемых ХИТ (аккумуляторов) важными электрическими характеристиками, кроме рассмотренных выше, являются также номинальное число зарядно-разрядных циклов и отдача по емкости М Q.
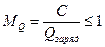
Так как часть сообщенного заряда Q заряд тратится на побочные процесса, отдача по емкости обычно меньше единицы. Используют также отдачу по энергии M W.
По определению реакции окисления называют анодными реакциями, реакции восстановления – катодными реакциями. Поэтому при разряде ХИТ анодом является отрицательный электрод «–», а катодом положительный электрод «+». Однако при заряде аккумулятора анод и катод меняются местами. Таким образом, термины «анод» и «катод» привязаны не к полярности электродов, а к направлению тока. Поэтому лучше пользоваться терминами «отрицательный электрод» и «положительный электрод».
Отметим важную роль электролиза воды в ограничении характеристик ХИТ с водным электролитом. Электролиз воды является одним из основных побочных процессов.
Схема электролиза воды.
Процесс Стандартный электродный потенциал
На положительном электроде: Н2О→0.5 О2 + 2Н+ + 2е Е о+ = 1.229 В
На отрицательном электроде: 2Н++ 2е→ Н2 Е о- = 0.000 В
Суммарная реакция: Н2О→0.5 О2 + Н2 Е о = 1.229 В
Эти реакции протекают параллельно с основной токообразующей реакцией, поэтому в принципе может идти и только одна из этих полуреакций (катодная или анодная), складываясь с основной полуреакцией. Разложение Н2О ограничивает возможное напряжение ХИТ с водным электролитом уровнем примерно 1.5 – 1.9 В. Действительно, большинство электрохимических систем с водным электролитом имеют напряжение ниже 2 В. Но за счет электродной поляризации этот диапазон может расширяться (пример – свинцовый аккумулятор, рабочее напряжение которого больше 2 В).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 877; Нарушение авторских прав?; Мы поможем в написании вашей работы!