
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Марганцево-цинковые элементы
|
|
|
|
Источники тока с цинковым анодом.
Цинк – очень удобный реагент для ХИТ: он является хорошим восстановителем с достаточно отрицательным потенциалом, коррозионно довольно устойчив в водных растворах, сравнительно дешев и нетоксичен. Теоретическая удельная емкость цинка составляет 830 А×ч/кг – это большая величина, больше только у легких щелочных и щелочноземельных металлов и алюминия. Цинковые аноды использовались еще в Вольтовом столбе и продолжают оставаться основными до сих пор.
Ежегодно в мире их производят более 10 млрд. штук. По некоторым сведениям, 90% всех выпускаемых в мире ХИТ – это система Zn-MnO2. Их широкое распространение связано с удачным сочетанием качеств: 1) относительная дешевизна; 2) удобство в эксплуатации; 3) приемлемая сохраняемость; 4) приемлемые электрические характеристики. Недостаток – падение рабочего напряжения по отношению к НРЦ, что связано с природой MnO2-катода и проявляется во всех системах, содержащих MnO2. Выше мы уже рассматривали токообразующую реакцию этой системы:
Zn + 2MnO2 + 2H2O = 2MnOOH + Zn(OH)2
Механизм электрохимического восстановления MnO2 сложен, поэтому данная токообразующая реакция не единственная, её следует рассматривать лишь как первое приближение. Для нее Е ≈ 1.7 В, фактически НРЦ ≈ 1.55 – 1.85 В.
Для одноэлектронного восстановления MnO2 теоретическая удельная емкость 308 А×ч/кг. Существует несколько модификаций MnO2: a, b, g, d, e, h, l. В элементах Zn-MnO2 используются пиролюзит (природная руда, b-MnO2), гамма-активированный пиролюзит (ГАП, g-MnO2), электролитический диоксид марганца (ЭДМ, g-MnO2, полученный электролизом раствора MnSO4) и химический диоксид марганца (ХДМ, h-MnO2, полученный разложением KMnO4). Качество материала возрастает в этом ряду.
Система Zn ½ NH4Cl, ZnCl2 ½ MnO2 (элемент Лекланше)
Элементы Лекланше (солевые батарейки) являются основным типом первичных ХИТ уже более 100 лет. Очень долго они были самыми распространенными, но с 1998 года их производство начало сокращаться. Ряд стран (например, США) полностью перешли на выпуск щелочных элементов Zn-MnO2, т.к. солевым элементам присущи серьезные недостатки: 1) резкое снижение напряжения при разряде, что приводит к почти линейно падающей разрядной характеристике; 2) резкое ухудшение параметров при отрицательной температуре и при увеличении токовой нагрузки; 3) не выдерживают импульсных режимов разряда.
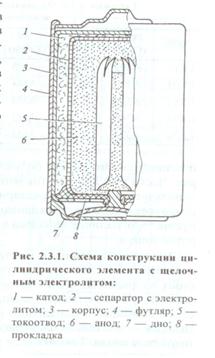
Конструкция. Конструктивно Zn-MnO2 чаще всего выпускаются в двух вариантах: «цилиндрическом» и «дисковом» (называемом также монетной или пуговичной конструкцией). Здесь показан разрез цилиндрического набивного элемента:
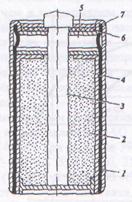
| 1 – отрицательный электрод (Zn) 2 – положительный электрод – брикет из спрессованной активной массы (MnO2 + углерод), увлажненный электролитом (NH4Cl + ZnCl2 + H2O + загуститель (крахмал)), в центре которого расположен токоотвод 3 – угольный стержень 4 – бумажный сепаратор с электролитной пастой 5 – газовая камера для сбора газов, выделяющихся при разряде и саморазряде 6 – изоляционная прокладка 7 – полимерный или картонный футляр |
Снаружи находится пластиковый или картонный футляр, или же дополнительный стальной корпус. Почти всё внутреннее пространство занято катодом, тем не менее, данная конструкция является катодноограниченной, т.к. здесь Zn – конструкционный материал, взятый в избытке, анод не расходуется полностью.
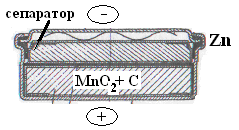
В дисковых элементах со стальным корпусом (см. рисунок) цинк не является конструкционным материалом и его требуется в 2 – 3 раза меньше.
Обозначение типоразмеров цилиндрических ХИТ
| Æ, мм | Высота, мм | Объем, см3 | МЭК* | США | Россия |
| 10.5 | R08 | O | |||
| 10.5 | 44.5 | R03 | AAA | ||
| 14.5 | 50.5 | 8.34 | R6 | AA | |
| 26.2 | R14 | C | |||
| 34.2 | 61.5 | 56.5 | R20 | D |
*МЭК – международная электротехническая комиссия.
Для цилиндрических и дисковых (пуговичных) элементов используется также система обозначений из 4 или 5 цифр, например: типоразмер 1225 означает Æ 12 мм, h = 2.5 мм, типоразмер 18650 = Æ 18 мм, h = 65.0 мм.
Характеристики Zn - MnO2 элементов. Для Zn - MnO2 элементов характерна сильная зависимость разрядной емкости от тока. Поэтому понятиями «номинальная емкость» и «номинальный ток» пользуются редко.
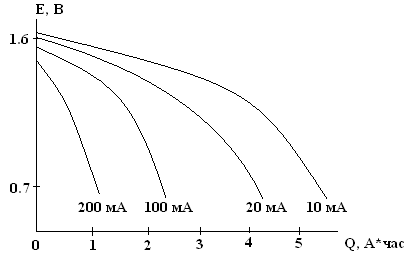
Разрядные кривые элемента 373 при комнатной температуре (V = 56.5 см3, W = 5.6 – 7.3 Вт×ч, Q = 3.8 – 4.9А×ч).
Элемент 316 с объемом 8.34 см3 должен иметь энергию примерно 0.8 – 1 Вт×ч, емкость 0.5 – 0.7 А×ч. Удельная энергия системы Zn-MnO2 составляет 50 – 85 Вт×ч/кг или 100 – 165 Вт×ч/л. Это невысокие показатели. Тем не менее, относительная дешевизна элемента – это его основное преимущество.
Температурный предел работоспособности элементов Лекланше около –200С (ниже не работают). Сохранность заряда (емкости) – от нескольких месяцев до 1 – 3 лет. Сохранность сильно зависит от температуры хранения (2 – 3 месяца при 450С приравниваются к 1 году при 250С). При –200С могут храниться годами без существенного снижения показателей.
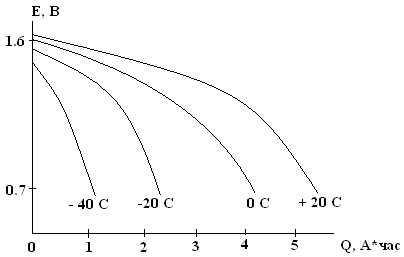
Разрядные характеристики элемента 373 при различных температурах (I = 10 мА).
Система Zn ½ KOH ½ MnO2
В других электрохимических системах с Zn анодом используется щелочной электролит. Это, как правило, концентрированный раствор КОН (25 – 40 масс. % КОН или 6 – 10 моль/л). Реже – 25% раствор NaOH (6 моль/л). В ХИТ всегда применяются высококонцентрированные или насыщенные растворы. Причины: 1) исходя из общих химических принципов, скорость процессов растет с ростом концентрации; 2) более прозаическая – расширение температурного диапазона в сторону низких температур требует незамерзающего электролита, поэтому лучше использовать эвтектические смеси. Для системы КОН – Н2О эвтектика приходится на 31 масс.% КОН (см. рисунок) и имеет tзам. = –670С. Максимум электропроводности приходится на 25 – 35 масс.% КОН в зависимости от температуры.

Сейчас Zn - MnO2 элементы всё больше выпускаются со щелочным электролитом (паста 30% КОН + загуститель). Их удельные характеристики ~ в 1.5 раза выше (80 – 125 Вт×ч/кг и 180 – 330 Вт×ч/л), чем солевых. Другие преимущества щелочных элементов: нет такого сильного падения емкости с током разряда и с температурой. В результате они могут быть лучше в 5 раз при разряде повышенным током. Сохранность заряда также лучше, чем у элементов Лакланше. Кроме того, щелочные элементы допускают повторный заряд после неглубокого разряда (не более 1/4 номинальной емкости).
| При их изготовлении используется другая технология и более качественные и дорогие материалы, поэтому они дороже. На корпусе изделия указано, как правило, щелочная или солевая система используется. Реакция анодного растворения цинка в щелочном растворе связана с расходом щелочи, которая не компенсируется в катодном процессе на другом электроде. Zn + 4OH- = ZnO22- + 2H2O + 2e 2MnO2 + 2H2O + 2e = 2MnOOH + 2OH- После насыщения раствора цинкатом, идет вторичный процесс с образованием нерастворимого гидроксида или оксида Zn + 2OH- = Zn(OH)2¯ + 2e (или ZnO¯ + H2O + 2e) В этом случае в суммарном процессе щелочь уже не расходуется. |
Существует также воздушно-цинковые элементы Zn½ NaOH ½O2 (на углеродном электроде с нанесенным катализатором восстановления кислорода) с ЭДС» 1.4 В (например, элемент «Крона») и суммарным токообразующим процессом
Zn + NaOH + 1/2O2 = NaHZnO2
или
Zn + 2NaOH + 1/2O2 = Na2ZnO2 + H2O
Система Zn ½ NaOH ½ CuO
Выпускаются уже более 100 лет. Токообразующая реакция в медно-цинковых элементах имеет вид
Zn + CuO + 2NaOH = Na2ZnO2 + Cu + H2O
с ЭДС = 1.058 В. Оксид меди восстанавливается до металлической меди, причем механизм реакции довольно сложен и протекает через стадию образования оксида одновалентной меди CuO ® Cu2O ® Cu.
Фактически НРЦ = 0.9 – 1.0 В. Удельная энергия очень мала: всего 35 – 40 Вт×ч/л или 25 – 30 Вт×ч/кг. Медно-цинковые элементы выпускаются в виде элементов большой емкости (до 1000 А×ч) для систем железнодорожной сигнализации, связи и т.д. Имеют баночную конструкцию: электроды погружены в большой объем щелочи.
Разрядное напряжение составляет 0.6 – 0.7 В. Предназначены для длительных разрядов малым током (до 3 мА/см2). Несмотря на низкое напряжение разряда и низкие удельные показатели, Zn|CuO-элементы используются в больших количествах в технике и на транспорте благодаря своей безотказности при длительной работе, стабильности напряжения и дешевизне. Саморазряд их ничтожен и они могут работать 10 – 15 лет при температурах до –100С.
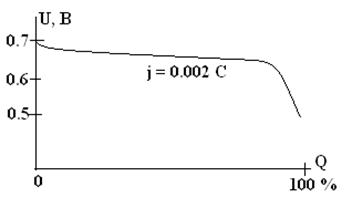
Разрядная характеристика Zn/CuO элемента (схематично).
Система Zn ½ KOH ½ HgO
Ртутно-цинковые (РЦ) элементы были разработаны в годы Второй мировой войны. Широко выпускаются до сих пор, в том числе для питания различной портативной электроники. В качестве электролита используется 40% раствор КОН (им пропитан сепаратор). Катодная полуреакция имеет вид
HgO + H2O + 2e = Hg + 2OH-
анодная полуреакция на цинке та же самая, что и в других щелочных системах
Zn + 2OH- = Zn(OH)2¯ + 2e или Zn + 2OH- = ZnO¯ + H2O + 2e
Суммарная токообразующая реакция
Zn + HgO = ZnO + Hg
Ртутно-цинковые элементы имеют очень стабильное НРЦ, точно равное ЭДС = 1.352 ± 0.002 В, которое почти не зависит от степени разряженности и от температуры. Поэтому эти элементы применяются также как эталоны напряжения.
Элементы выпускаются в виде герметичных элементов малой емкости – от 0.05 А×ч до 15 А×ч. Конструкция дисковая (пуговичная). Активная масса положительного электрода состоит из красной модификации HgO, смешанной для электропроводности с 5 – 15 масс.% графита. Активная масса отрицательного электрода – спрессованный порошок цинка. Элементы выпускают анодноограниченными, т.е. HgO находится в избытке (для безопасности при переразряде). Разрядные характеристики хорошие.
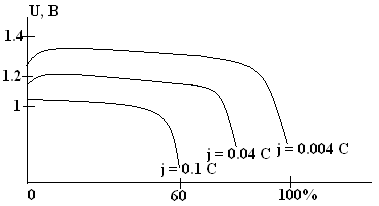
Разрядные характеристики Zn/HgO элемента при разной токовой нагрузке (схематично).
Ртутно-цинковые элементы рассчитаны на длительный разряд малыми токами. Основные достоинства – 100% использование активных веществ, малогабаритность, очень высокая стабильность разрядного напряжения, довольно высокая удельная энергия (100 – 120 Вт×ч/кг) и самая высокая среди традиционных ХИТ объемная удельная энергия (400 – 500 Вт×ч/л). Последнее достигается за счет высокой плотности материалов и плотной сборки. Высокая сохраняемость – 5 – 10 лет при обычной температуре. Недостатки – высокая стоимость и токсичность ртутного сырья.

| 
|
Система Zn ½ KOH ½ AgO (Ag2O)
Серебряно-цинковые (СЦ) источники тока являются аккумуляторами, т.е. перезаряжаемыми. Начали выпускаться в 1940-х годах и получили распространение в основном в специальных областях: в авиации, ракетной и космической технике и др. Причина – высокая стоимость. Серебряно-цинковые аккумуляторы (СЦА) содержат примерно 4 – 5 г Ag на 1 А·ч, поэтому используются только в случаях, когда другие варианты ХИТ непригодны, и важность поставленной цели оправдывает большие затраты. Электролит – 40% KOH, насыщенный K2ZnO2.
Элементы выпускаются в разряженном виде, так что сначала делается первичный заряд. На положительном электроде при заряде протекает следующий процесс:
I ступень 2Ag + 2OH- = Ag2O + H2O + 2e
После окисления примерно трети или половины всего серебра процесс по I ступени внезапно прекращается и начинает идти реакция по II ступени при другом напряжении (большем на 0.3 Вольт):
II ступень 2Ag + 2OH- = AgO + H2O + 2e
После расхода почти всего серебра происходит новый резкий рост напряжения, и начинается электролиз воды с выделением кислорода. Эти процессы четко разделены на разрядной кривой.
На отрицательном Zn электроде протекают те же реакции, что и в других щелочных системах, так что суммарные токобразующие реакции при заряде и разряде следующие:
I ступень (I) Zn + Ag2O «ZnO + 2Ag E = 1.599 В (ЭДС= НРЦ)
II ступень (II) Zn + AgO «ZnO + Ag E = 1.859 В (ЭДС= НРЦ)
НРЦ полностью заряженного СЦА определяется реакцией (II) и равно 1.86 В. НРЦ частично разряженного СЦА определяется реакцией (I) и равно 1.6 В.
Разряд положительного электрода также протекает ступенчато, что отражается на разрядной кривой ступенькой:
I ступень 2AgO + H2O + 2e = Ag2O + 2OH-
II ступень Ag2O + H2O + 2e = 2Ag + 2OH-

Зарядные и разрядные характеристики СЦА при различных токовых нагрузках и температурах (схематично).
При увеличении тока разряда до 2С (это очень большая токовая нагрузка, соответствующая полному разряду за ½ часа) емкость аккумуляторов меняется очень мало, что является большим достоинством данного типа ХИТ. СЦА допускают разряд как малыми, так и очень большими токами (в последнем случае длительность разряда ограничивается в основном перегревом аккумулятора).
Удельные параметры СЦА составляют 90 – 130 Вт×ч/кг и 180 – 200 Вт×ч/л – это очень высокие цифры для вторичных систем (например, у свинцовых аккумуляторов в 5 – 10 раз меньше). Сейчас этот уровень превышен лишь для металл-гидридных и литий-ионных аккумуляторов, о которых речь пойдет ниже. Ресурс СЦА составляет от 30 до 200 зарядно-разрядных циклов (в зависимости от конструктивного варианта и условий эксплуатации), срок службы до 2 лет. Работоспособны до –400С, заметное снижение емкости начинается с –200С.
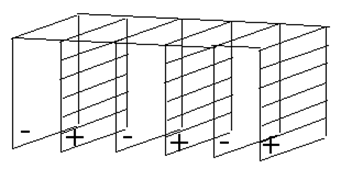
Конструкция – дисковое или призматическое баночное исполнение. Очень плотно собранный электродный блок находится в пластиковом корпусе (банке). Чередующиеся положительные и отрицательные пластины разделены сепараторами и электрически скоммутированы друг с другом.
Положительный электрод изготавливают прессованием серебряного порошка, отрицательный – прессованием смеси Zn + ZnO + связующее. Особенность эксплуатации СЦА – он должен храниться в разряженном состоянии. Опасен перезаряд.
Вариант СЦА – замена цинкового отрицательного электрода на кадмиевый. Токообразующая реакция в этом случае практически та же самая (с заменой Zn на Cd). Цена такого аккумулятора еще выше, а удельная энергия вдвое ниже (70 Вт×ч/кг и 130 Вт×ч/л). Достоинством является высокий ресурс – более 300 циклов.
Система Pb ½ H2SO4 ½ PbO2 (свинцовый аккумулятор)
Свинцовый аккумулятор (СА) является наиболее распространенным в настоящее время вторичным ХИТ. Более половины всего мирового производства свинца расходуется на изготовление свинцовых аккумуляторов. Широкое распространение этих аккумуляторов обусловлено их относительной дешевизной и довольно хорошими показателями в работе. Они обладают высоким и стабильным напряжением, мало меняющимся с температурой и с токами нагрузки (хотя сильнее, чем у СЦА). Ресурс составляет от 100 до 1000 циклов, а для некоторых типов СА – более 1000 циклов.
Первый действующий образец свинцового аккумулятора был создан в 1859 году, серийно СА выпускаются с конца XIX века. Токообразующие полуреакции следующие (с учетом того, что в концентрированном растворе H2SO4 диссоциирует только по первой ступени):
на положительном электроде
(+) PbO2 + 3H+ + HSO4- +2e «PbSO4¯ + 2H2O
на отрицательном электроде
(–) Pb + HSO4- «PbSO4¯ + H+ +2e
суммарная токообразующая реакция
разряд
PbO2 + Pb + H2SO4 «2 PbSO4 + 2H2O НРЦ = ЭДС = 2.047 В при 250С
заряд
Для Pb/PbO2-системы НРЦ точно равно ЭДС. В свою очередь ЭДС зависит от концентрации электролита в соответствии с уравнением Нернста (с учетом того, что в концентрированных растворах активность воды отличается от единицы):
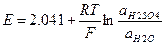
Согласно токообразующей реакции, при разряде СА расходуется большее количество H2SO4, при заряде СА кислота вновь образуется. Степень снижения концентрации электролита для данного аккумулятора однозначно связана с количеством протекающего электричества. Поэтому измерение плотности электролита служит точным средством определения степени заряженности аккумулятора. В этом отношении СА выгодно отличается от других систем. Обычно рекомендуемая плотность электролита для стартерных аккумуляторов 1.25 г/см3 в летний период и 1.28 г/см3 в зимний период. В общем случае плотность электролита может меняться от 1.30 г/см3 до 1.20 г/см3. Этим величинам плотности r соответствуют концентрации, активности и напряжения в соответствии с таблицей:
| r, г/см3 | H2SO4, масс. % | С, М | аH2SO4 | аH2O | ЭДС, В |
| 1.20 | 3.43 | 1.14 | 0.78 | 2.059 | |
| 1.30 | 5.31 | 34.6 | 0.57 | 2.154 |
При полном разряде концентрация электролита падает до 12 – 20 масс.%, r < 1.15 г/см3, НРЦ £ 2 В.
Свинцовые аккумуляторы выпускают средне- и крупногабаритными и подразделяют на стартерные (5 – 200 А×ч), тяговые (40 – 1200 А×ч) и стационарные (5 – 5000 А×ч). Типичные зарядные и разрядные кривые СА имеют вид.
Зарядные и разрядные характеристики СА при различной токовой нагрузке (схематично).
Конечное напряжение разряда ниже начального на 0.2 В и составляет 1.8 В для малых токов и 1.2 – 1.5 В для больших. Вторая половина заряда может сопровождаться выделением О2 на положительном электроде, поэтому отдача по емкости будет меньше 1. Для достижения полного заряда его продолжают после скачка напряжения до 2.6 – 2.7 В при обильном выделении Н2 и О2 на обоих электродах.
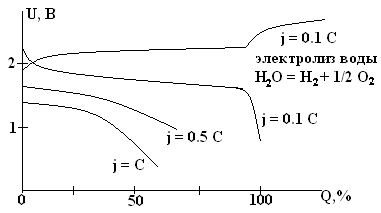
Недостатки СА: емкость довольно сильно зависит от тока. Изменение емкости весьма заметно даже при j = 0.05 – 0.2 C(см. рисунок вверху). Емкость довольно сильно зависит от температуры (см. рисунок внизу). При большой плотности тока эта зависимость еще более резкая. Эту зависимость можно улучшить, увеличив концентрацию H2SO4, на чем основана рекомендация увеличивать плотность электролита в зимнее время.
Зарядные и разрядные характеристики СА при различной температуре (схематично).
В стартерном режиме аккумуляторы работоспособны до –300С. Аккумуляторы заряжают в многоступенчатом режиме с уменьшением тока, так как активная масса электродов портится от сильного газовыделения. Можно заряжать и потенциостатически при U = 2.2 – 2.5 В. Современные зарядные устройства обеспечивают оптимальный режим эксплуатации ХИТ.
Нормальное состояние свинцового аккумулятора – полностью заряженное. Хранить СА разряженным недопустимо. Глубокий разряд свинцового аккумулятора очень вреден для него. До недавнего времени СА требовали обслуживания в виде доливки воды в электролит (в электролит можно доливать только дистиллированную воду взамен испарившейся и разложившейся). В последние годы выпускаются герметизированные необслуживаемые СА.
Удельная энергия невелика: 10 – 40 Вт×ч/кг или 50 – 90 Вт×ч/л (для различных типов). Ресурс стартерных СА составляет обычно 3 – 5 лет (200 – 400 циклов, хотя измерять ресурс в циклах здесь не вполне корректно, поскольку в стартерном режиме аккумулятор не выполняет полных циклов разряд/заряд), ресурс тяговых и стационарных СА – до 1000 – 2000 циклов.
Конструкция – призматический баночный пластиковый моноблок. Моноблок разделен на отдельные ячейки, соединенные последовательно. 12 В-аккумулятор состоит из 6 таких ячеек. В каждой находится электродный блок, состоящий из вертикальных положительных и отрицательных пластин, погруженных в электролит.

|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1431; Нарушение авторских прав?; Мы поможем в написании вашей работы!