
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики. На основе первого начала термодинамики возникает возможность определения тепловых эффектов химических и физико-химических процессов
|
|
|
|
На основе первого начала термодинамики возникает возможность определения тепловых эффектов химических и физико-химических процессов. Существует несколько формулировок первого начала:
Разные формы энергии переходят друг в друга в строго эквивалентных соотношениях;
В любой изолированной системе запас внутренней энергии остается постоянным;
Невозможно получить работу без затраты энергии;
Для конечного изменения состояния системы 1-й закон термодинамики выражается уравнением:
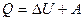 (13)
(13)
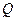 – теплота, подведенная к системе или отведенная от системы
– теплота, подведенная к системе или отведенная от системы
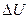 – изменение внутренней энергии
– изменение внутренней энергии
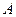 - суммарная работа, совершаемая системой
- суммарная работа, совершаемая системой
Q=DU+pDV(14)
Уравнение является математическим выражением первого закона термодинамики.
Количество теплоты, подведенное к системе или отведенное от нее идет на изменение внутренней энергии и на работу совершаемую над системой.
Применительно к различным термодинамическим процессам математическое уравнение первого закона термодинамики записывается для:
Изобарный процесс. (Р = сonst)
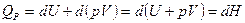 (15)
(15)
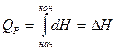
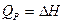
Количество теплоты изобарного процесса является мерой изменения энтальпии.
Изохорный процесс. ( = сonst),
= сonst),
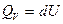
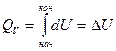
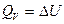 (16)
(16)
Количество теплоты, подведенное к системе расходуется на изменение внутренней энергии.
Изотермический процесс. (Т = сonst)

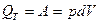 (17)
(17)
Теплота, сообщенная к системе целиком, превращается в работу расширения. Для 1 моль газа 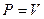 , тогда выражение принимает вид:
, тогда выражение принимает вид:
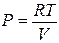
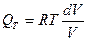
R=const, RT=const, p1V1= p2V2 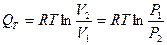
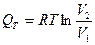 (18)
(18)  (19)
(19)
Между внутренней энергией и энтальпией существует связь:
DН=DU+pDV
pDV= DnRT, значит DН=DU+DnRT
Последнее уравнение справедливы, когда хотя одно из исходных веществ или продуктов реакции представляет собой газ. Для химических реакций в конденсированных средах (жидкость, твердое тело) различие между DН и DU несущественно – им обычно пренебрегают.
Закон Гесса
Тепловой эффект химических реакций не зависит от пути перехода (процесса), а определяется только начальным и конечным состоянием системы. Тепловой эффект реакции рассчитывают при стандартных условиях (давлении -1,013 10 5 Па, температуре- 298 К) по теплотам образования и сгорания.
Теплотойобразования называют тепловой эффект реакции образования 1 моль данного соединения из простых веществ при р – 1, 013 105 Па и Т- 298 К,при условии, что все участники реакции находятся в устойчивых агрегатных состояниях.
Тепллотой сгорания называют теплоту, выделяющую при сгорании 1 моль вещества при стандартных условиях до простейших оксидов.
Первое следствие закона Гесса.
|
|
|
Дата добавления: 2014-01-07; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!