
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантово-механическая теория водородоподобного атома
|
|
|
|
Лекция №24
Тема: Квантовая механика. Гипотеза де Бройля. Дифракция электронов. Вероятный смысл волн де Бройля. Соотношения неопределенности Гейзенберга и границы их применения. Уравнение Шредингера. Физический смысл волновой функции.
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10 м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда, который на основании своих исследований по рассеянию α-частиц в веществе в 1911 году предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z – порядковый номер элемента в системе Менделеева, е – элементарный заряд), размер 10-15 – 10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.
Не смотря на то, что модель атома Томсона была отвергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным. Преодоление возникших трудностей потребовало создания новой – квантовой теории атомов.
Первая попытка построить качественно новую – квантовую теорию атома была предпринятая 1913 году датским физиком Нильсом Бором. В основу своей теории Бор положил два постулата. Рассмотрим это на примере атома водорода.
Простейшим по своему строению атомом является атом водорода, состоящий из ядра, вокруг которого движется электрон. Согласно первому постулату Бора, он движется по одной из круговых орбит, не излучая энергии. Причем момент количества движения электрона по этой орбите равен целому кратному некоторой величины 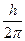 ,т. е. mVnrn = n
,т. е. mVnrn = n 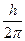 , где m – масса электрона; Vn – его скорость на n – орбите; h = 6,62 IО-34 Дж; с – постоянная Планка; rn – радиус этой орбиты; n – главное квантовое число (n = 1,2,3,...). При переходе электрона с одной орбиты на другую атом водорода излучает или поглощает один квант энергии (второй постулат Бора: hn = E2 – E1 где n – частота излучения).
, где m – масса электрона; Vn – его скорость на n – орбите; h = 6,62 IО-34 Дж; с – постоянная Планка; rn – радиус этой орбиты; n – главное квантовое число (n = 1,2,3,...). При переходе электрона с одной орбиты на другую атом водорода излучает или поглощает один квант энергии (второй постулат Бора: hn = E2 – E1 где n – частота излучения).
Энергия электрона в атоме на соответствующей орбите может быть вычислена по формуле:
E = -  ,
,
где e – заряд электрона; m – масса электрона; e0 – диэлектрическая проницаемость вакуума; n = 1,2,3,... – номер орбиты.
Длина волны l излучения, испускаемого атомом водорода при переходе с одной орбиты на другую, может быть определена из формулы:
1/l = R (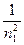 -
-  ),
),
где R = 1,097 107 1/м и называется постоянной Ридберга; n1 и n2 – номера орбит. Формула называется сериальной формулой.
В спектре атома водорода обнаружено пять серий спектральных линий. Серия Лаймана соответствует излучению в ультрафиолетовой части спектра электромагнитных волн, серия Бальмера – видимой и серии Пашена, Брикетта и Пфундта – инфракрасной.
Наряду с определенными успехами в теории Бора обнаружились и существенные недостатки: невозможность применить к многоэлектронным атомам, рассчитать интенсивность линий излучения и другие, но она явилась переходным этапом к созданию квантовой механики. х
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 451; Нарушение авторских прав?; Мы поможем в написании вашей работы!