
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изопроцессы идеального газа
|
|
|
|
Тема 4. Термодинамические процессы.
4.1. Метод исследования т/д процессов.
Как сказано выше первый закон т/д устанавливает взаимосвязь между количеством теплоты, внутренней энергией и работой. При этом, количество теплоты подводимое к телу или отводимое от тела зависит от характера процесса.
К основным т/д процессам относятся: изохорный, изотермический, изобарный иадиабатный.
Для всех этих процессов устанавливается общий метод исследования, который заключается в следующем:
• выводится уравнение процесса кривой Pυ и TS – диаграммах;
• устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
• определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа:
Äu = сvм|0t2·t2 - сvм|0t1·t1. (4.1)
или при постоянной теплоемкости ÄU = m·сv·(t2 - t1); (4.2)
вычисляется работа: L = P·(V2 – V1); (4.3)
определяется количество теплоты, участвующее в процессе:
q = cx·(t2- t1); (4.4)
определяется изменение энтальпии по формуле, справедливой для всех процессов идеального газа:
·t2 – сpм|0
t1·t1, (4.5)
или при постоянной теплоемкости: Äi = сp·(t2 – t1); (4.6)
определяется изменение энтропии:
Äs = cv·ln(T2/T1) + R·ln(υ 2/υ 1); (4.7) Äs = cp·ln(T2/T1) - R·ln(P2/P1); (4.8) Äs = cv·ln(T2/T1) + cp·ln(υ 2/υ 1). (4.9)
Все процессы рассматриваются как обратимые.
1). Изохорный процесс (Рис.4.1).
í = Const, í 2 = í 1. (4.10)
Уравнение состояния процесса:
P2 / P1 = T2 / T1. (4.11)
Так как υ 2 = υ 1, то l = 0 и уравнение 1-го закона т/д имеет вид:
q = Äu = = сv·(t2 - t1); (4.12)

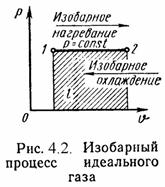
2). Изобарный процесс (Рис.4.2). P = Const, P2 = P1
Уравнение состояния процесса:
í 2 /í 1 = T2 / T1, (4.13)
Работа этого процесса:
l = P·(í 2 - í 1). (4.14)
Уравнение 1-го закона т/д имеет вид:
q = Äu + l = ср·(t2 - t1); (4.15)
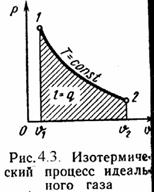
3). Изотермический процесс (Рис.4.3).
Т = Const, Т2 = Т1
Уравнение состояния:
P1 / P2 = í 2 / í 1, (4.16)
Так как Т2 = Т1, то Äu = 0 и уравнение 1-го закона т/д будет иметь вид:
q = l = R·T·ln(í 2/í 1), (4.17)
или q = l = R·T·ln(P1/P2), (4.18)
где R = Rç/ ç– газовая постоянная [Дж/(кг·К)].
4). Адиабатный процесс (Рис.4.4).
В данном процессе не подводится и не отводится тепло, т.е. q =0.
Уравнение состояния:
P· íë= Const, (4.19)
где ë = cp / cv – показатель адиабаты.
Уравнение 1-го закона т/д будет иметь вид:
l = -Äu = = -сv·(t2 – t1) = сv·(t1 – t2), (4.20)
или
l = R·(T1 – T2) / (ë -1); (4.21)
l = R·T1·[1 – (í 1/ í 2) ë-1] /(ë – 1); (4.22)
l = R·T2·[1 – (P2/P1) (ë-1)/ ë] /(ë – 1). (4.23)
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 298; Нарушение авторских прав?; Мы поможем в написании вашей работы!