
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расход воздуха на горение
|
|
|
|
Минимальное количество воздуха, необходимого для полного сгорания единицы массы (кг) или объема (м3) горючего вещества, называется теоретически необходимым и обозначается VI. В табл. 1 приведены значения VI для различных горючих веществ при нормальных условиях (0°С и 101,3 кПа).
Значения величин, приведенных для древесины, торфа, бензина, керосина, нефти и водяного газа, являются средними, так как состав этих горючих материалов непостоянен. Вид формулы для расчета теоретически необходимого количества воздуха зависит от состава горючего вещества.
Таблица 1. Теоретически необходимое количество воздуха для полного сгорания веществ
| Горючее вещество | Количество воздуха для сгорания 1 кг вещества, мЗ | Горючее вещество | Количество воздуха для сгорания 1 кг вещества, мЗ |
| Ацетон | 9,45 -7,35 | Ацетилен | 15,4 -11,9J |
| Бензол | 13,2 - 10,25 | Бутан | 39,8 - 30,94 |
| Бензин | 14,3 -11,1 | Водород | 3,08- 2,38 |
| Древесина (W=7%) | 5,4-4,18 | Водяной газ | 2,84 - 2,2 |
| Керосин | 14,85-11,5 | Метан | 12,3- 9,52 |
| Нефть | 13,9-10,8 | Оксид углерода | 3,08 - 2,38 |
| Толуол | 12,9-10,0 | Пропан | 30,6 - 23,8 |
| Торф (воздушно- сухой) | 7,5-5,8 | Природный газ | 6,45 - 5,0 |
Горючее вещество — индивидуальное химическое соединение. Для таких горючих веществ независимо от их агрегатного состояния теоретически необходимое количество воздуха определяется из уравнений реакции горения. На m кмоль горючего вещества приходится п кмоль кислорода и азота из уравнения реакции горения. Обозначив массу (в кг) горючего вещества, численно равную молекулярной массе его, через М, составляют пропорцию
тМ кг—n 22,4 м3
1 кг—VB0 м3
где 22,4 — объем 1 кмоль газов (при О °С и 101325 Па).
Теоретически необходимый объем воздуха для сгорания 1 кг вещества равен (из пропорции) 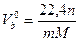 (1)
(1)
Если объем воздуха, полученный по формуле (1), необходимо привести к иным условиям, то пользуются формулой
 (2),
(2),
где Т — заданная температура газов, К; р — заданное давление, Па.
Теоретически необходимый объем воздуха для сгорания 1 м3 горючих газов определяется по формуле
V°B = n/m (3)
Пример 1. Определить объем воздуха, необходимый для сгорания 1 кг бензола при 20 оС и давлении 99992 Па. Составляем уравнение реакции горения бензола в воздухе
C6H6 + 7,5O2 + 7,5.3,76N2 = 6CO2 + 3H2O + 28,2N2
Согласно уравнению реакции на горение 1 кмоля бензола требуется n=7,5+7,5-3,76=35,7 кмоля воздуха. Молекулярная масса бензола 78.
По уравнению (1) определяем теоретически необходимый объем воздуха для сгорания 1 кмоля бензола при нормальных условиях
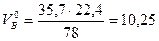 м3/кг.
м3/кг.
 При заданных условиях этот объем будет равен [уравнение (2)}
При заданных условиях этот объем будет равен [уравнение (2)}
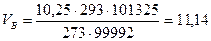 м3/кг.
м3/кг.
Пример 2. Определить объем воздуха, необходимый для сгорания 4 м3 ацетилена. Составляем уравнение реакции горения ацетилена в воздухе
С2Н2 + 2,5О2 + 2,5-3,76Nj = 2СОг + Н2О+ 9,4N2
Согласно уравнению реакции, на горение 1 кмоля ацетилена необходимо 2,5+2,5-3,76=11,9 кмолей воздуха. Определяем объем воздуха, необходимый для горения 4 м3 ацетилена
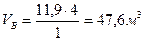 .
.
Горючее вещество — сложная смесь химических соединений. Такими веществами являются древесина, торф, каменный уголь и др. Для определения теоретически необходимого объема воздуха нужно знать элементный состав горючего вещества, выраженный в массовых процентах, т. е. содержание С, Н, О, S, N, золы (А), влаги (W). Элементный состав вещества определяют в аналитической лаборатории. Чтобы рассчитать  , запишем уравнение реакции горения углерода, водорода и серы и массовое соотношение реагирующих веществ
, запишем уравнение реакции горения углерода, водорода и серы и массовое соотношение реагирующих веществ
С + О2 = СО2 à+ О2 = 2Н2О S + О2 = SO3
12+32=44 4 + 32 = 36 32 + 32 = 64
Если для сгорания 12 кг углерода требуется 32 кг кислорода, то для 0,01 кг углерода, т. е. 1% (масс.) его потребуется кислорода 0,01-32/12 = 0,01-8/3 кг, для водорода соответственно потребуется 0,01-32/4 = 0,01-8 кг и для серы 0,01 -32/32 =0,01•1 кг кислорода.
Для полного сгорания 1 кг горючего вещества потребуется кислорода (в кг)
 ,
,
где [С], [Н], [S], [О]—содержание углерода, водорода, серы и кислорода в горючем веществе, % (масс).
На вычисленное количество кислорода в воздухе приходится в 77/23 раза больше азота. Сумма азота и кислорода составляет массу воздуха L\ (в кг), необходимую для горения 1 кг вещества

После преобразования получим
 . (4)
. (4)
Чтобы выразить количество воздуха в объемных единицах, нужно правую часть выражения (4) разделить на массу 1м3 воздуха при нормальных условиях, т. е. на 1,293 кг/м3. В результате получим
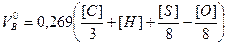 . (5)
. (5)
Пример 3. Определить объем воздуха, необходимый для сгорания 5 кг торфа, состоящего из 40,0% С, 4,0% Н, 13,0% О и 20,0% N; А= 10%; W=13,0%. Азот, зола и влага горючего вещества при определении количества воздуха не учитываются, так как они не принимают участия в реакции. Объем воздуха, необходимый для сгорания 1 кг торфа, определяем по формуле (5)
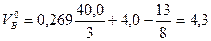 м3/кг.
м3/кг.
Для сгорания 5 кг торфа потребуется воздуха 4,3.5=21,5 м3.
Горючее вещество — смесь газов. К этой группе веществ относятся горючие газы, например природный, доменный, коксовый и др. Все они в том или ином количестве содержат СО, СН4, Н2, H2S, C2H4 и др. Состав горючих газов обычно выражают в объемных процентах. Для вывода формулы расчета VI напишем уравнение реакции горения наиболее распространенных газов:
СН4 + 2О2 = СО2 + 2Н2О H2S + 1, 5О2 = Н2О + SO2
2СО + О2 = 2СО2 2На + О2 = 2Н2О
Если для сгорания 1 м3 метана требуется 2 м3 кислорода, как это видно из уравнения, то для сгорания 0,01 м3 метана, т. е. 1% (об.) потребуется 0,01.2 м3 кислорода. Для сгорания 1 м3 оксида углерода потребуется 0,01/2 м3 кислорода, такое же количество кислорода потребуется для сгорания 1 м3 водорода, а для сгорания сероводорода необходимо 0,01.1,5 м3 кислорода.
Для полного сгорания 1 м3 горючего газа потребуется кислорода (в м3)
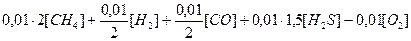 ,
,
где [СН4], [Н2], [СО], [H2S] и [О2] — содержание метана, водорода, оксида углерода, сероводорода и кислорода, % (об.).
В воздухе на этот объем кислорода приходится в 79/21 раза больше азота. Сумма азота и кислорода составляет объем (м3) воздуха, необходимый для сгорания 1 м3 газа
 .
.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 6727; Нарушение авторских прав?; Мы поможем в написании вашей работы!