
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определяем объем влажных продуктов сгорания метана
|
|
|
|
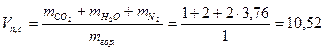 м3/м3
м3/м3
Горючее вещество — сложная смесь химических соединений. Если известен элементный состав сложного горючего вещества, то состав и количество продуктов сгорания 1 кг вещества можно определить по уравнению реакции горения отдельных элементов. Для этого составляют уравнения реакции горения углерода, водорода, серы и определяют объем продуктов сгорания, приходящийся на 1 кг горючего вещества. Уравнение реакции горения углерода имеет вид
С + Оа + 3,76N2 = СО2 + 3,76N2
При сгорании 1 кг углерода получается 22,4/12=1,86 м3 СО2 и 22,4-3,76/12 = 7,0 м3 N2.
Аналогично определяют объем (в м3) продуктов сгорания 1 кг серы и водорода. Полученные данные приведены ниже
СО2 N2 H2O SO2
Углерод 1,86 7,0 — —
Водород — 21,0 11,2 —
Сера..... — 2,63 — 0,7
При горении углерода, водорода и серы кислород поступает из воздуха. Однако в состав горючего вещества может входить кислород, который также принимает участие в горении. В этом случае воздуха на горение вещества расходуется соответственно меньше.
В составе горючего вещества могут находиться азот и влага, которые в процессе горения переходят в продукты сгорания. Для учета их необходимо знать объем 1 кг азота и паров воды при нормальных условиях. Объем 1 кг азота равен 0,8 м3, а паров воды 1,24 м3.
В воздухе при 0°С и давлении 101325 Па на 1 кг кислорода приходится 3,76-22,4/32 = 2,63 м3 азота.
На основании приведенных данных определяют состав и объем продуктов сгорания 1 кг горючего вещества.
Пример 7. Определить объем и состав влажных продуктов сгорания 1 кг каменного угля, состоящего из 75,8% С, 3,8% Н, 2,8% О, 1,1% N, 2,5% S, №=3,0%, А = 11,0%. Объем продуктов сгорания будет следующий, м3:
| Компоненты | СО2 | Н2О | N2 | SO2 |
| Углерод | 1,86-0,758=1,4 | - | ||
| Водород | 11,20,038=0,425 | |||
| Сера | ||||
| Азот в горючем веществе | - | - | ||
| Влага в горючем веществе | 1,24-0,03=0,037 | |||
| Сумма | 1,4 | 0,462 | ||
| Углерод | 7-0,758=5,306 | - | ||
| Водород | 21-,038=0,798 | - | ||
| Сера | 2,630,025=0,658 | 0,70,025=0,017 | ||
| Азот в горючем веществе | 0,80,011=0,0088 | |||
| Влага в горючем веществе | - | - | ||
| Сумма | 6,7708—0,0736 | - 0,017 =6,6972 |
Из общего объема азота вычитают объем азота, приходящийся на кислород в составе каменного угля 0,028.2,63=0,0736 м3. Итог таблицы указывает состав продуктов сгорания каменного угля. Объем влажных продуктов сгорания 1 кг каменного угля равен
Vn,c= 1,4+ 0,462+ 6,6972+ 0,017 = 8,576 м3/кг
Горючее вещество — смесь газов. Количество и состав продуктов сгорания для смеси газов определяют по уравнению реакции горения компонентов, составляющих смесь. Например, горение метана протекает по следующему уравнению
СН4 + 2О2 + 2-3,76N2 = СОа + 2Н2О + 7,.52N2
Согласно этому уравнению, при сгорании 1 м3 метана получается 1 м3 диоксида углерода, 2 м3 паров воды и 7,52 м3 азота. Аналогично определяют объем (в м3) продуктов сгорания 1 м3 различных газов:
| СО2 | Н2О | N2 | SO2 | |
| Водород | — | 1,0 | 1,88 | — |
| Оксидуглерода | 1,0 | — | 1,8 8 | — |
| Сероводород | 1,0 | — | 5,64 | 1,0 |
| Метан | 1,0 | 2,0 | 7,52 | — |
| Ацетилен | 2,0 | 1,0 | 9,4 | — |
| Этилен | 2,0 | 2,0 | 11,28 | - |
На основании приведенных цифр определяют состав и количество продуктов сгорания смеси газов.
Пример 8. Определить объем влажных продуктов сгорания 1 м3 доменного газа, состоящего из 10,5% СО2, 28% СО, 0,3% СН4, 2,7% Н2 и 58,5% N2. Объем продуктов сгорания будет следующий, м3:
| СО2 | Н2О | N2 | |
| Оксид углерода | 1. 0,28=0,28 | — | 1,88. 0,28=0,526 |
| Водород | — | 1..0,027=0,027 | 1,88..0,027=0,05 |
| Метан | 1. 0,003=0,003 | 2. 0,003=0,006 | 7,52. 0,003=0,022 |
| Диоксид углерода в составе газа | 0,105 | — | — |
| Азот в составе газа... | — | — | 0,585 |
| Сумма | 0,388 | 0,033 | 1,183 |
Объем продуктов сгорания 1 м3 доменного газа равен
Vn,c = 0,388 + 0,033+ 1,183 = 1,604 м3/м3
Анализ продуктов сгорания, взятых на пожарах в различных помещениях, показывает, что в них всегда содержится значительное количество кислорода. Если пожар возникает в помещении с закрытыми оконными, дверными или другими проемами, то пожар при наличии горючего может продолжаться до тех пор, пока содержание кислорода в смеси воздуха с продуктами сгорания в помещении не снизится до 14—16% (об.). Следовательно, на пожарах в закрытых помещениях содержание кислорода в продуктах сгорания может быть в пределах от 21 до 14% (об.). Состав продуктов сгорания, взятых во время пожаров в помещениях с открытыми проемами (подвал, чердак), показывает, что содержание в них кислорода может быть ниже 14% (об.):
| СО | СО2 | О2 | |
| В подвалах | 0,15-0,5 | 0,8-8,5 | 10,6-19 |
| На чердаках | 0,1-0,6 | 0,3-4,0 | 16,0-20,2 |
По содержанию кислорода в продуктах сгорания на пожарах можно судить о коэффициенте избытка воздуха, при котором происходило горение.
Пример 9. Определить коэффициент избытка воздуха при пожаре в помещении, если во взятом на анализ дыме содержалось 19% (об.) О2. Коэффициент избытка воздуха находим, пользуясь отношением (8)
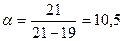 .
.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2922; Нарушение авторских прав?; Мы поможем в написании вашей работы!