
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамическое состояние тела
|
|
|
|
Термодинамическое состояние тела (например, газа) характеризуется его массой 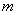 , молярной массой μ, давлением
, молярной массой μ, давлением 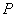 , объемом
, объемом  , температурой
, температурой 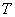 (а возможно, и другими величинами, например, определяющими его химический состав). Все эти величины называются термодинамическими параметрами тела. Однако, как будет видно из дальнейшего, такие параметры, как
(а возможно, и другими величинами, например, определяющими его химический состав). Все эти величины называются термодинамическими параметрами тела. Однако, как будет видно из дальнейшего, такие параметры, как  ,имеют смысл только тогда, когда тело находится, хотя бы приближенно, в так называемом состоянии термодинамического равновесия (т.д.р.). Так называется состояние, в котором все термодинамические параметры остаются со временем постоянными (к этому следует добавить еще условие отсутствия стационарных потоков). Если, например, быстро подогревать газ, как это показано на рис. 9.1, температура непосредственно подогреваемой части сосуда А окажется выше температуры части В. Не будут равны и давления в частях А и В. В этом случае не имеет смысла понятие температуры
,имеют смысл только тогда, когда тело находится, хотя бы приближенно, в так называемом состоянии термодинамического равновесия (т.д.р.). Так называется состояние, в котором все термодинамические параметры остаются со временем постоянными (к этому следует добавить еще условие отсутствия стационарных потоков). Если, например, быстро подогревать газ, как это показано на рис. 9.1, температура непосредственно подогреваемой части сосуда А окажется выше температуры части В. Не будут равны и давления в частях А и В. В этом случае не имеет смысла понятие температуры 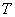 или давления
или давления 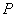 всего газа. Другой пример – впустим в газ пучок быстрых молекул. Ясно, что не имеет смысла говорить о температуре газа до тех пор, пока быстрые молекулы, вследствие ряда столкновений с другими, не приобретут скоростей порядка средней скорости остальных молекул, иначе говоря, пока система не придет в состояние т.д.р.
всего газа. Другой пример – впустим в газ пучок быстрых молекул. Ясно, что не имеет смысла говорить о температуре газа до тех пор, пока быстрые молекулы, вследствие ряда столкновений с другими, не приобретут скоростей порядка средней скорости остальных молекул, иначе говоря, пока система не придет в состояние т.д.р.

В состоянии т.д.р. для каждого вещества термодинамические параметры связаны между собой так называемым уравнением состояния:

| (9.1) |
Таким уравнением состояния для идеального газа является уравнение Менделеева – Клапейрона:
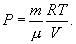
| (9.2) |
Здесь R=8,31 Дж/(мольК) – универсальная газовая постоянная, μ - молярная масса. Для углерода (С) величина μ составляет 12г, для водорода (H2) – 2г, для кислорода (О2) – 32г, для воды (Н2О) – 18г и т.д.
В моле любого вещества содержится одно и то же количество молекул N0, называемое числом Авогадро:

| (9.3) |
Это объясняется тем, что значение моля любого вещества выбрано пропорциональным массе молекулы этого вещества. Масса молекулы может быть получена делением массы моля на число Авогадро:

| (9.4) |
Отношение универсальной газовой постоянной R к числу Авогадро (т.е. универсальная газовая постоянная, приходящаяся на одну молекулу) называется постоянной Больцмана:
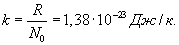
| (9.5) |
В формулу (9.2) входят еще давление, объем, температура и масса газа. Давление Р в системе СИ измеряется в ньютонах на квадратный метр или паскалях (Н/м2=Па), объем V – в кубических метрах (м2), масса m – в килограммах (кг), температура T – в кельвинах (К). Абсолютная температура Т отсчитывается от абсолютного нуля (-273,15°С), т.е. Т=t+273,15, где t – температура по Цельсию.
Если количество вещества равно 1 молю, то (9.2) превращается в

| (9.6) |
Идеальным газом называется газ, настолько разреженный, что он подчиняется уравнению (9.2) или(9.6). Смысл этого определения состоит, очевидно, в том, что для подчинения уравнению (9.6) газ должен быть достаточно разреженным. Если газ, напротив, сжат до достаточно больших плотностей (так называемый реальный газ), то вместо (9.6) имеем

| (9.7) |
Это – уравнение состояния реального газа или уравнение Ван-дер-Ваальса. Здесь a и b – постоянные.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 620; Нарушение авторских прав?; Мы поможем в написании вашей работы!