
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики. Энтропия
|
|
|
|
Второе начало термодинамики является фундаментальным законом природы. Оно охватывает самый широкий круг природных явлений и указывает направление, в котором самопроизвольно протекают термодинамические процессы.
Второе начало термодинамики, как и первое, имеет несколько формулировок.
Невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, полностью в работу.
Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Эти формулировки показывают, что тепловые процессы являются необратимыми. Мерой необратимости процесса, мерой хаотичности является энтропия.
К определению энтропии S можно прийти на основе анализа работы тепловых машин. Если система получает тепло 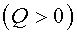 или отдает тепло
или отдает тепло  , то состояние ее меняется. Тогда, при изменении состояния системы, можно найти не саму энтропию, а только ее изменение, т. е.
, то состояние ее меняется. Тогда, при изменении состояния системы, можно найти не саму энтропию, а только ее изменение, т. е.

Для тепловой машины изменение энтропии нагревателя и холодильника равны:
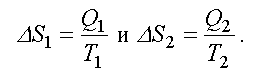
Формула 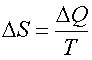 справедлива для изотермического процесса и представляет собой термодинамическое определение энтропии. Энтропией называется термодинамическая величина, изменение которой в системе пропорционально изменению ее тепловой энергии, деленной на абсолютную температуру. Для любого процесса можно найти бесконечно малое изменение энтропии, т. е. ее дифференциал
справедлива для изотермического процесса и представляет собой термодинамическое определение энтропии. Энтропией называется термодинамическая величина, изменение которой в системе пропорционально изменению ее тепловой энергии, деленной на абсолютную температуру. Для любого процесса можно найти бесконечно малое изменение энтропии, т. е. ее дифференциал

где  - элементарная теплота (см. формулу (4.16)).
- элементарная теплота (см. формулу (4.16)).
В интегральной форме для любого процесса изменение энтропии равно

Найдем изменение энтропии за один цикл для тепловой машины. Из неравенства (4.20) следует, что 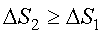 . Полное изменение энтропии за цикл больше или равно нулю
. Полное изменение энтропии за цикл больше или равно нулю

Знак равенства Δ S = 0 относится к обратимым процессам, которые являются бесконечно медленными процессами.
Знак неравенства Δ S > 0 относится к необратимым процессам. В реальных системах все процессы необратимы. Например, расширение газа, выравнивание температуры.
Таким образом, второе начало термодинамики формулируется и как закон возрастания энтропии (4.24).
Во всех необратимых процессах в замкнутой системе энтропия всегда возрастает.
Возрастание энтропии сопровождается выравниванием температуры или плотности газа. Это можно связать с порядком и беспорядком. Под порядком будем понимать сосредоточение частиц или энергии в определенном месте пространства, а под беспорядком (хаосом) - равномерное распределение их во всем объеме. Тогда возрастание энтропии при совершающихся без внешних воздействий необратимых процессах отражает природное стремление систем переходить от состояния более упорядоченного в состояние менее упорядо-ченное. Этот процесс сопровождается рассеянием (или диссипацией) энергии.
Как мы видим, второе начало термодинамики определяет направленность тепловых процессов в изолированных системах, они всегда протекают в сторону роста энтропии, в сторону увеличения беспорядка. Капелька туши растворяется во всем объеме, колечко сигаретного дыма тает, огонь костра гаснет, разрушаются горы, гаснут звезды и т. д. Вся практическая деятельность людей как в технике, так и в сельском хозяйстве, представляет собой не что иное, как создание из природных материалов искусственных структур, т. е. в том или ином смысле борьбу с самопроизвольным ростом энтропии.
Возникновение упорядоченных структур возможно только в незамкнутых, т. е. в открытых системах. Открытой системой называется система, которая обменивается энергией и веществом с окружающей средой. В открытых системах энтропия может как возрастать, так и убывать в зависимости от знака 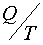 .
.
Трудами Ильи Пригожина (датский физик русского происхождения) строго доказано, что в открытых системах, находящихся в неравновесном состоянии, при определенных условиях из хаоса может возникать порядок. Процесс возникновения из хаоса упорядоченных структур называется самоорганизацией. Процессы самоорганизации являются общими для живой и неживой природы.
Феномен жизни является примером сохранения и увеличения упорядоченности и, следовательно, уменьшения энтропии. Жизненный цикл наблюдается только в открытых системах. Он включает в себя три стадии: рождение, развитие, смерть. На первых двух стадиях энтропия понижается, возникает и развивается структура. На этих стадиях живой организм поддерживает связь с окружающей средой. На третьей стадии система становится замкнутой, энтропия возрастает и достигает максимума. В этом смысле жизнь - это борьба с возрастанием энтропии. Человек существует, пока он активно поддерживает связь с окружающим миром, обменивается с ним энергией, веществом и информацией.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 645; Нарушение авторских прав?; Мы поможем в написании вашей работы!