
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Постулаты Бора. Первая квантовая теория строения атома быда предложена в 1913 г
|
|
|
|
Первая квантовая теория строения атома быда предложена в 1913 г. датским физиком Нильсом Бором. Она была основана на ядерной модели атома, согласно которой атом состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны.
Теория Бора основана на двух постулатах.
I постулат Бора - постулат стационарных состояний. В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергию. Этим стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением энергии.
II постулат Бора получил название "правило частот". При переходе электрона с одной стационарной орбиты на другую излучается (или поглощается) квант энергии, равный разности энергий стационарных состояний

где h - постоянная Планка;
v - частота излучения (или поглощения) энергии;
hv - энергия кванта излучения (или поглощения);
En и Em - энергии стационарных состояний атома до и после излучения (поглощения), соотвественно. При Em < En происходит излучение кванта энергии, а при Em > En - поглощение.
По теории Бора значение энергии электрона в атоме водорода равно
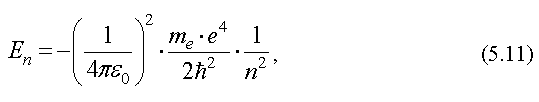
где me - масса электрона,
e - заряд электрона,
εe - электрическая постоянная,
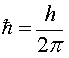 ,
,
h - постоянная Планка,
n - целое число, n = 1,2,3,...
Таким образом, энергия электрона в атоме представляет собой дискретную величину, которая может изменяться только скачком.
Набор возможных дискретных частот квантовых переходов определяет линейчатый спектр атома

Вычисленные по этой формуле частоты спектральных линий для водородного атома оказались в прекрасном согласии с экспериментальными данными. Но теория не обясняла спектры других атомов (даже следующего за водородом гелия). Поэтому теория Бора была только переходным этапом на пути построения теории атомных явлений. Она указывала на неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 496; Нарушение авторских прав?; Мы поможем в написании вашей работы!