
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Роль белков в организме человека
|
|
|
|
Белки
Пептиды
Тема: ПЕПТИДЫ, БЕЛКИ: ИХ СТРОЕНИЕ, СВОЙСТВА, ЗНАЧЕНИЕ В ОРГАНИЗМЕ, МЕТОДЫ ИССЛЕДОВАНИЯ. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
Пептиды — органические молекулы, в состав которых входит несколько остатков аминокислот, связанных пептидной связью. В зависимости от количества остатков аминокислот и молекулярной массы различают:
- Низкомолекулярные пептиды, содержащие в своем составе от двух до десяти остатков аминокислот. Например, ди-, три-, тетра-, пента-пептиды и т. д.
- Пептиды со средней молекулярной массой — от 500 до 5000 Д, так называемые «средние молекулы».
- Высокомолекулярные пептиды с молекулярной массой от 5000 до 16000 Д.
Биологическое значение пептидов. Пептиды обладают значительной биологической активностью, являясь регуляторами ряда процессов жизнедеятельности. В зависимости от характера действия и происхождения пептиды делят на несколько групп:
- Пептиды-гормоны: например, вазопрессин, окситоцин, глюкагон, кальцитонин, рилизинг-факторы и др.;
- Пептиды, участвующие в регуляции пищеварения: гастрин, секретин, панкреатический полипептид (ПП), вазоактивный интестинальный полипептид (ВИП) и др.;
- Пептиды крови: глутатион, ангиотензин, брадикинин, каллидин и др.;
- Нейропептиды: пептиды памяти, пептиды сна, эндорфины, энкефалины и др.;
- Пептиды, участвующие в сокращении мышц: анзерин, карнозин;
- Пептиды «средние молекулы» — внутренние эндотоксины, образующиеся в организме в результате различных патологических процессов, обусловливающих тяжесть протекания заболевания.
Белки — полимеры 22 природных аминокислот со специфической структурой.
Первичная структура — последовательность аминокислотных остатков в полипептидной цепи, образуется за счет пептидных связей, возникающих за счет альфа-карбоксильной группы одной аминокислоты и альфа-аминогруппы последующей аминокислоты.
Вторичная структура — способ укладки полипептидной цепи в альфа-спираль или b - структуру за счет менее прочных водородных связей (Нd+ …Оd-).
Третичная структура — пространственная укладка a - спирали или полипептидной цепи в определенную конформацию за счет четырех видов связей:
1. 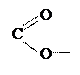 водородных: Нd+ …Оd-,
водородных: Нd+ …Оd-,
2. ионных (солеобразующих): —NH3 +...,
3. дисульфидных: —S—S—;
4. гидрофобных (сил Ван-дер-Ваальса).
Третичная структура — субъединица.
Четвертичная структура— «комплекс субъединиц способных к диссоциации, (Джон Бернал), или объединение в определенном порядке двух и большего количества субъединиц в молекулу олигомерного белка.
Например, молекула гемоглобина состоит из четырех субъединиц (по 17000 Д каждая).
- Ферментативная — в клетке участвуют в биохимических реакциях 2000 различных ферментов, и все они по химической природе — белки (простые или сложные).
- Гормональная — в организме человека 50% всех гормонов имеют белковую природу.
- Рецепторная — избирательное связывание различных регуляторов — гормонов, биогенных аминов, простагландинов, медиаторов, циклических мононуклеотидов, протекает с помощью белков-рецепторов.
- Структурная (пластическая) — мембраны всех клеток и субклеточных единиц представляют собой бислой: белки и фосфолипиды, т. е. белки играют роль в формировании всех клеточных структур.
- Иммунологическая — гуморальный иммунитет организма человека связан с наличием g-глобулинов (антител).
- Гомеостатическая — свертывание крови связано с наличием в крови белков свертывания крови (факторов).
- Противосвертывающая — антитромбиновая, антитромбопластиковая и фибринолитическая системы связаны с наличием в крови соответствующих белков.
- Геннорегуляторная — белки-гистоны, кислые белки играют роль в регуляции процесса трансляции.
- Транспортная — перенос О2, ВЖК, липидов, стероидов, витаминов, лекарственных веществ осуществляют различные фракции белков крови.
- Сократительная — в работе мышц участвуют белки: актин, миозин, тропонин и тропомиозин.
- Обезвреживающая — при отравлениях солями тяжелых металлов (свинец, медь, цинк и др.) и алкалоидами противоядием являются белки (особенно молочных продуктов).
- Опорная (механическая) — прочность соединительной, хрящевой и костной ткани за счет белков — коллагена, эластина, фибронектина.
- Создание биопотенциалов мембран и клеток и внутренней мембраны митохондрий.
- Энергетическая — 1 г. белка, окисляясь до конечных продуктов — мочевины, углекислого газа и воды, дает 4,1 ккал энергий.
Методы разделения белков и пептидов:
- Электрофоретические — основаны на разделении белков в постоянном электрическом поле в зависимости от величины заряда белковой молекулы.
- Ультрацентрифугирование — основано на различной скорости седиментации отдельных белков в зависимости от их молекулярной массы.
- Хроматографические: а) ионообменная хроматография — основана на различной способности отдельных белков к обмену с ионами ионообменных смол; б) на молекулярных ситах (гель-фильтрация) — на сефадексах — белки разделяются в зависимости от величины молекулы; в) аффинная хроматография — белки делятся на индивидуальные в зависимости от средства к аффинату (наполнителю колонок).
- Высаливание — чаще с помощью сернокислого аммония — основано на снятии заряда и водной оболочки различными концентрациями солей. Это старый метод разделения белков.
- Аминокислотный состав белков и пептидов после гидролиза определяют в аминокислотном анализаторе.
Дисперсные системы в зависимости от раздробленности частиц могут быть:
1) грубодисперсными взвесями (частицы больше 100 нм),
2) коллоидными растворами (частицы от 1 до 100 нм),
3) ионно-молекулярными растворами (частицы меньше 1 нм).
Растворы ВМС в организме человека по своим свойствам приближаются к коллоидным растворам — их называют «молекулярные коллоиды».
Признаки коллоидного состояния:
- Наличие двух фаз — дисперсной фазы и дисперсионной среды;
- Гетерогенность системы — наличие поверхности раздела между дисперсной фазой и дисперсионной средой;
- Определенная степень раздробленности частиц (от 1 до 100 нм);
- Определенная степень устойчивости, обусловленная двумя факторами — зарядом и водной оболочкой.

| ||
| истинные молекулярные растворы, так как частица ВМС — отдельная молекула | коллоидные растворы, так как обладают свойствами коллоидных растворов |
Сходство растворов ВМС и коллоидных растворов:
- Величина частиц (от 1 до 100 нм);
- Наличие двух факторов устойчивости: заряда и водной оболочки;
- Явление опалесценции;
- Способность к коагуляции;
- Способность к диализу;
- Медленная диффузия;
- Способность к седиментации;
- Низкое осмотическое давление.
Отличие растворов ВМС от коллоидных растворов:
- В растворах ВМС частицы — молекулы ВМС, а не мицеллы.
- У частиц ВМС в растворах иной механизм возникновения заряда: диссоциация собственных ионогенных групп, а не адсорбция из растворов потенциалоопределяюших ионов, добавленных в избытке.
- У частиц гидрофильных ВМС иной механизм образования водной оболочки: наряду с зарядом частицы водная оболочка образуется за счет гидрофильных групп, расположенных на поверхности частицы.
- Растворы ВМС термодинамически более устойчивы (DG<0).
- Растворы ВМС образуются самопроизвольно, (не нужен «стабилизатор»).
- Растворы ВМС обратимы.
Сходство растворов ВМС с ионно-молекулярными растворами:
- В растворе ВМС находятся в виде молекул.
- Термодинамически устойчивы (DG<0).
- Образуют гомогенные системы.
- Образуются самопроизвольно, не требуют «стабилизатора».
Специфические свойства растворов ВМС:
- Способность к набуханию.
- Способность к желатинированию.
- Наличие аномальной вязкости.
- Свободное вращение отдельных звеньев полимеров с изменением конформации.
Мембранное равновесие Доннана показывает, как распределяется электролит по обе стороны полупроницаемой мембраны клеток, если в клетке содержится ВМС (белки).
- До начала распределения —
в клетке: вне клетки:
R — Na — (соль белка) NaCl— электролит
[R-] = С1 [Na+] = С2
[Na+] = С1 [Сl-] = С2
Ионов хлора совсем нет в клетке, поэтому они переводят в клетку из внеклеточного пространства, а вместе с ними в клетку переходит часть ионов натрия.
- Обозначим количество веществ, перешедших в клетку X, тогда после перераспределения электролита:
в клетке: вне клетки:
[R-] = С1 [Na+] = С2 — X
[Na+] = С1 + Х
[Сl-] = X [Сl-] = С2 — X
Переход ионов электролита осуществляется до тех пор пока установится ионное равновесие, т.е. произведения концентраций ионов по обе стороны мембраны должны быть равны:
[Na+] кл. ´ [Сl-] кл. = [Na+] вне кл. ´ [Сl-] вне кл.
(C1 + Х) ´ Х = (С2 — X) ´ (С2 — X),
откуда 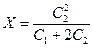 — уравнение мембранного равновесия Доннана.
— уравнение мембранного равновесия Доннана.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 492; Нарушение авторских прав?; Мы поможем в написании вашей работы!