
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пороки развития нижних мочевых путей
|
|
|
|
Аномалии развития мочевого пузыря.
Агенезия мочевого пузыря считается несовместимой с жизнью. В настоящее время производят операцию раздельной пересадки мочеточников в сигмовидную кишку или операции типа Модлинского.
Врожденный дивертикул мочевого пузыря - мешкообразное выпячивание всех стенок пузыря. Различают врожденные дивертикулы, сообщающиеся с пузырем узким отверстием и в него открывается устье мочеточника или в основе лежит слабость мышц участков стенки мочевого пузыря.
Приобретенные дивертикулы образуются вследствие выпячивания слизистой оболочки пузыря между волокнами детрузора и по существу представлены собственно слизистой мочевого пузыря, До присоединения инфекции клиника бессимптомна. Инфицирование проявляется пиурией, дизурией, акт мочеиспускания в два приема. Лечение при этом оперативное - дивертикулэктомия.
Экстрофия мочевого пузыря - это врожденное отсутствие передней стенки мочевого пузыря, вследствие нарушения эмбриогенеза на 4-6 неделе внутриутробного развития плода. У мальчиков она обычно сочетается с тотальной эписпадией, а у девочек с недоразвитием влагалища и его преддверия. Клинически данная аномалия развития характеризуется отсутствием нормальной толщи передней брюшной стенки ниже пупка и пролабированием слизистой оболочки задней стенки мочевого пузыря. Таким образом, передняя брюшная стенка в надлобковой области представлена задней стенкой мочевого пузыря. Диаметр пролабирования может колебаться от 2 до 8 см. В результате постоянной травматизации и присоединения инфекции происходит рубцово-папиломатозные изменения.
Чаще всего нормальное пупочное кольцо отсутствует. Подтекающая моча
вызывает явления дерматита, порок сочетается с расхождением костей лонного сочленения, что обусловливает утиную походку. С этим пороком нередко наблюдаются: выпадение прямой кишки, двусторонняя паховая грыжа, гидронефроз, мегауретер, подковообразная почка, крипторхизм.
Детей с данной патологией надо оперировать в первые дни жизни, пока не присоединились явления инфекции, папиломатозные разрастания, дерматит. Операции можно разделить на 3 группы:
- образование мочевого пузыря и его внутреннего сфинктера из собственной стенки;
- отведение мочи в сигмовидную кишку;
- создание искусственного мочевого пузыря.
Врожденная гипертрофия детрузора - характеризуется первичной гипертрофией детрузора без нарушения уродинамики в шеечно-уретральном сегменте, уретре и припуциальном мешке. Этот порок ведет к нарушению пассажа мочи и вторичным нарушениям в мочеточниках и почках. Лечение оперативное - удаление детрузора и замена его петлей кишки.
Пороки развития урахуса.
Эти пороки являются производным внутрибрюшинного отрезка аллантоиса и на ранних стадиях эмбриогенеза представляют собой проток, соединяющий мочевой пузырь с аллантоисом, расположенным в пупочном канатике. В зависимости от того, на каком уровне сохранен просвет урахуса, различают следующие пороки: полное незаращение урахуса, частичное незаращение урахуса, незаращение верхнего отдела, среднего и нижнего отделов.
Полный мочевой свищ пупка характерным признаком является выделение из пупка мочи струйкой или по каплям. При инфицировании стенок урахуса развивается клиника цистита, и моча содержит примесь гноя. Диагноз устанавливают на основании УЗИ, рентгенконтрастного исследования, цистоскопии. Лечение оперативное - иссечение урахуса на всем протяжении.
При неполном свище урахуса отделяемое серозное, примеси мочи не бывает. Рекомендуется консервативное лечение, направленное на облитерацию свища.
Киста урахуса связана с метаплазией переходного эпителия урахуса в цилиндрический эпителий, продуцирующий серозную жидкость. Кисты различают: околопузырные, промежуточные и околопупочные. До инфицирования клинически не проявляются. Нагноение кисты осложняется флегмоной передней брюшной стенки или перитонитом. Лечение кист урахуса хирургическое с одномоментным удалением урахуса до мочевого пузыря.
Ложный (верхушечный) дивертикул мочевого пузыря это незаращение нижней части урахуса. Клиника его зависит от величины, диаметра сообщения с мочевым пузырем, наличия дивертикулита, но чаще всего диагностируется случайно. Лечение оперативное - удаление дивертикула.
Врожденная патология пузырно-уретерального сегмента.
К этой патологии относят контрактуру и склероз шейки мочевого пузыря, мегатреугольник, клапан задней уретры, ее стеноз, гипертрофию семенного бугорка. Независимо от морфологических изменений в области пузырно-уретрального сегмента клинически обструкция его проявляется рядом общих симптомов. Сначала это функциональные, а затем необратимые органические изменения вышележащих отделов. Наиболее ранняя жалоба - затрудненное мочеиспускание и беспокойство при нем. Струя прерывистая, ступенчатая, тонкая и слабая. Эта патология осложняется ПМР, уретерогидронефрозом, пиелонефритом. Лечение может быть консервативное и оперативное. Консервативное - до 5-6 мес., далее оперативное.
Пороки развития уретры.
Гипоспадия - это сложный порок развития наружных половых органов, включающий недоразвитие задней висячей части уретры и дистопию ее наружного отверстия от головки до промежности, а в тяжелых случаях недоразвитие полового члена. Различают следующие формы: головчатая, коронарная, стволовая, мошоночная, промежностная, врожденное недоразвитие уретры. Лечение оперативное.
Эписпадия - это порок развития, при котором отсутствует передняя стенка мочеиспускательного канала. У мальчиков различают три формы: головчатая, стволовая, тотальная. У девочек - клиторная, субсимфизарная и полная.
Врожденный дивертикул уретры - это наличие выпячивания по ходу мочеиспускательного канала, увеличивающееся при мочеиспускании, что затрудняет акт мочеиспускания (он резко прерывается или вяло, по каплям). Застой мочи может приводить к образованию конкремента, ПМР, хроническому пиелонефриту. Лечение дивертикула уретры оперативное.
Врожденное сужение уретры может быть на различном уровне мочеиспускательного канала: на границе простатического отдела и внутреннего сфинктера, между простатической и перепончатой частями, перепончатым и луковичным отделом, кавернозной и головчатой уретрой. По форме различают кольцевидные, цилиндрические, диафрагмальные и клапанные сужения. Основной симптом при данном пороке - затруднение акта мочеиспускания. Лечение бескровное - бужирование, оперативное - резекция уретры.
Аномалии положения яичка.
В процессе эмбриогенеза яичко проходит сложный путь от нижнего полюса первичной почки до дна мошонки. К концу 3 месяца мигрирует к глубокому паховому кольцу, к 5 месяцу - опускается до уровня пахового кольца, 7 месяц - преодолевает паховый канал и к 8-9 опускается полностью в мошонку. Различают: абдоминальный, паховый крипторхизм, эктопию яичка. Лечение оперативное.
ПРИНЦИПЫ ДЕТСКОЙ ОНКОЛОГИИ
Цель лекции: уметь диагностировать онкологические заболевания у детей.
План лекции:
1. Вступление.
2. Диагностика злокачественных новообразований.
3. Принципы химиотерапии.
4. Принципы поддерживающей терапии.
5. Принципы лучевой терапии.
Сведения об истории развития детской онкологии очень важны, так как они отражают этапы развития всей специальности и современное состояние вопроса. Детская онкология выделилась как самостоятельная дисциплина в 1948 году, когда Фарбер и соавторы сообщили о возможности достижения временной ремиссии у детей с острым лимфобластным лейкозом при лечении антагонистом фолиевой кислоты - аминоптерином. Это сообщение является самым ранним свидетельством того, что химиотерапия может эффективной в лечении злокачественных опухолей у детей. Другой большой шаг вперед был сделан в 1956 году, когда в лечении солидной опухоли – хориокарциномы, был использован метотрексат. Комбинации нескольких химиотерапевтических препаратов стали использовать в лечении болезни Ходжкина и острого лимфобластного лейкоза в 60-е годы, что в конечном счете привело к использованию данного метода фактически при опухолях детского возраста.
Успешное применение комбинированного лечения в детской онкологии сначала было продемонстрировано при опухоли Вильмса. Комбинированный лечебный подход подразумевает объединенное использование оперативного вмешательства, лучевой терапии и химиотерапии. Этот принцип, который теперь используется повсеместно во всех областях онкологии, поначалу был разработан совместными усилиями детских хирургов, радиологов и детских онкологов в 50-х и 60-х годах. Другой прогрессивной разработкой в педиатрической онкологии явилось создание совместных междисциплинарных национальных клинических исследовательских групп, чтобы на научной основе проверить эффективность новых схем лечения, адьювантной химиотерапии при таких опухолях как остеосаркома, использовать высокодозные программы химиотерапии для улучшения результатов лечения опухолей поздних стадий и понять закономерности роста клетки путем идентификации генов подавляющих рост опухоли (ретинобластома). Развитие и использование этих принципов является залогом прогресса и ведут к значительному улучшению показателей выживания и качества жизни у детей со злокачественными опухолями.
Эпидемиология и статистика выживания. Злокачественные новообразования у детей относительно редки и составляют всего около 2% случаев рака у людей. Однако, после травмы это вторая, наиболее частая причина смерти у детей старшее 1 года. Приблизительно 130 случаев раковых образований у детей выявляется ежегодно среди 1 миллиона детей моложе 15 лет. Приблизительно 9000 случаев диагностируются ежегодно в Соединенных Штатах. С 1973 по 1987 год в США отмечено увеличение заболеваемости на 4%. Лейкозы - наиболее часто встречающаяся форма рака у детей, а опухоли мозга – самые распространенные солидные опухоли. Далее следуют лимфомы, нейробластома, саркомы мягких тканей, опухоль Вильмса и остеосаркома; каждый тип опухолей составляет от 5% до 8% общего количества.
Несмотря на популярное мнение, что многие виды рака вызываются различными факторами окружающей среды, убедительных свидетельств, подтверждающих это утверждение, недостаточно. Причины большинства случаев рака детства неизвестна. Например, мы располагаем клиническим наблюдением, когда девушка в возрасте 14 лет в дни аварии на Чернобыльской АС проездом находилась в г.Киеве, а спустя 6 месяцев заболела острым лимфобластным лейкозом. Лечение в течение 1 года привело к выздоровлению. Спустя 5 лет пациентка вышла замуж и родила мальчика, у которого в возрасте 2,5 лет была диагностирована нефробластома.
Однако, некоторые приобретенные и врожденные факторы играют определенную роль при отдельных типах рака у детей, таких как ретинобластома (см. ниже). Многие исследователи полагают, что такие факторы существуют и при других формам детских опухолей, однако не ясно, относятся ли они к молекулярным или генетическим изменениям. Выживание детей со злокачественными новообразованиями значительно улучшилось, с тех пор Фарбер достиг первого выздоровления при остром лейкозе. В начале 60-х выживало приблизительно 30% детей с раком. К концу 80-х излечение наблюдалось уже у 65%-70% детей. Эти значительные успехи являлись следствием трех важных факторов: 1) опухоли детского возраста были чувствительны к химиотерапевтическим средствам; 2) использовался комбинированный метод лечения; 3) большинство детей получало лечение в специализированных педиатрических онкологических центрах в рамках клинических протоколов, использовавших самое современное и многообещающее лечение. Приведем общие данные о частоте встречаемости отдельных опухолей детского возраста. Следует подчеркнуть, что эти данные мало разнятся в различных странах.
Частота встречаемости злокачественных опухолей у детей.
| ТИП ОПУХОЛИ | % ОБЩЕГО КОЛИЧЕСТВА |
| Лейкозы Опухоли мозга Лимфомы Нейробластома Саркомы Опухоль Вильмса Остеосаркома Ретинобластома Опухоли печени |
Опухолевая биология. Злокачественная опухоль является результатом генетических изменений, которые происходят в отдельной клетке. Поиск причин, которые приводят к таким изменениям - главное направление биологических исследований при злокачественных новообразованиях. Процесс злокачественного преобразования клетки зависит от 2-х типов генов: онкогенов – стимуляторов роста и супрессоров - генов-подавителей.
Ранние исследования установили, что из опухоли выделяются вирусы, позже названные ретровирусами, которые содержали некоторые гены, способные преобразовывать нормальные клетки в культуре в злокачественные. Было также установлено, что вирусные онкогены существуют в нормальных клетках. Но они неактивны, поэтому их назвали проонкогенами. Всего было открыто почти 100 онкогенов. Открытие, что смесь нормальных и злокачественных клеток в культуре, может продуцировать клеточные элементы, которым не присущ злокачественный рост, стало свидетельством того, что существует и другой класс генов, которые могут подавлять опухолевый рост. Данные наблюдения привели к открытию семейства супрессорных генов, известных как антионкогенов. Эти гены для регуляции клеточного роста. Их утрата или инактивация заканчивается нерегулируемым ростом клетки и раком. В настоящее время известны 7 генов-супрессоров и расшифрован механизм их действия в клеточном цикле.
Цитогенетика рака. Понимание генетической природы детского рака началось с регистрации неслучайных хромосомных аберраций в клетках опухоли. Это стало возможным в 1971 году, когда был разработан метод комплексного хромосомного анализа. Онкогены и антионкогены гены впоследствии были обнаружены в участках хромосомных аберраций. В конце 80-х появился использующий флуоресцентную ДНК метод, который позволил выявлять и уточнять локализацию отдельных генов в хромосомах. Эта техника повысила возможности идентификации и уточнения локализаций, связанных с раком генетических отклонений.
В различных солидных опухолях и при гематологических заболеваниях были выявлены многочисленные последовательные цитогенетические аномалии. Они были обнаружены в клетках саркомы Юинга, герминогенных опухолей, глиомы, медулобластомы, примитивных нейроэктодермальных опухолей, ретинобластомы, рабдомиосаркомы, синовиальной саркомы и опухоли Вильмса. Идентификация этих аномалий позволяет идентифицировать новообразования в сложных случаях. Хромосомные отклонения могут также использоваться для формирования прогноза заболевания. Важным прогностическим фактором является также такая цитогенентическая характеристика опухолевых клеток – как способность накапливать или терять ДНК. Сравнение содержания общего количества ДНК в нормальных и опухолевых клетках методом проточной цитометрии определяет клеточный индекс ДНК. Нормальные человеческие клетки диплоидны и имеют равный единице ДНК-индекс. Клетки, содержащие больший чем обычный диплоидный набор в 46 хромосом, называются гиперплоидными и имеют ДНК-индекс больше единицы. Пациенты с нейробластомой, рабдомиосаркомой, медулобластомой, например, которые имеют опухоли с ДНК-индексом больше единицы, имеют лучший прогноз, и более плохой прогноз среди пациентов остеосаркомой и опухолью Вильмса.
Клеточный рост и его регуляция. Нормальный клеточный рост осуществляется путем регулируемой прогрессии в рамках клеточного цикла, состоящего из репликации ДНК и митоза, разделенных двумя фазами роста G1 и G2. Клетки также могут временно выходить из цикла и вступать в состояние отдыха, обозначенного G0 (рис. 1 А).
Чтобы пройти цикл клетка инструктируется внеклеточными стимулирующими факторами, которые передаются с помощью сигнальных белков от поверхности клетки через цитоплазму и в ядро. Здесь белки связываются с ДНК, что заканчивается экспрессией регулирующих рост генов. Эти гены вовлекаются при каждом шаге на пути передачи сигналов, чтобы стимулировать или предотвращать деление клетки, вызывать ее дифференцировку или давать сигнал к началу процесса гибели, называемого апоптозом. Онкогены стимулируют рост и деление, а гены-супрессоры регулируют частоту прохождения клетки через цикл. Канцерогенез возникает, когда нормальный контроль смягчается, что обычно происходит в результате активации стимулирующего рост онкогена или регулирующего гена супрессора.
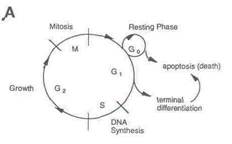
Рис.1 A. Клеточный цикл.
Нормальный клеточный рост осуществляется организованным способом с клетками, проходящими через циклы репликации ДНК (S) и митоза (M). Эти циклы разделяются двумя стадиями роста G1 и G2. Клеткам даются команды для выхода из цикла (переход в состояние отдыха), дифференцировки или гибели.
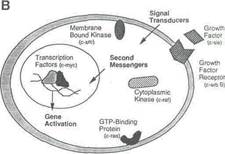
Рис.1 B. Сигнал клетке к трансдукции.
Протоонкогенные факторы (примеры в круглых скобках) действуют на всех этапах трансдукционного сигнала, которые продвигают клетку по циклу. Существо процесса состоит в связывании внеклеточных факторов роста с мембранными рецепторами фактора роста, таким образом, стимулируя протеин-киназную деятельность рецептора. Другие белки связываются с фосфорилирующим рецептором и передают сигнал к ядру, с помощью направляющихся через мембрану и цитоплазму посыльных. Это активизирует ядерные факторы транскрипции, которые связываются с ДНК и затрагивают транскрипцию генов-активаторов роста.
Увеличение клеточной популяции происходит в результате одного из следующих процессов: 1) сокращение продолжительности клеточного цикла; 2) увеличение числа клеток, участвующих в цикле; 3) уменьшение количества умирающих клеток. Быстро делящиеся клетки накапливают больше генетических дефектов, активируют большее количество онкогенов, утрачивают тормозящие регуляторы и становятся все более и более злокачественными.
Долгое время подозревалась возможность генетического наследования злокачественных заболеваний. Установление факта, что в некоторых случаях ретинобластома имеет аутосомно-доминантный тип наследования, стало моделью для понимания наследственных типов рака. Семейные формы ретинобластомы составляют приблизительно 50% случаев заболевания. В отличие от спорадических односторонних ретинобластом, семейная форма имеет тенденцию быть многоочаговой, двусторонней и возникает в более раннем возрасте.
Зародышевые мутации генов супрессоров описаны у членов семей с синдромом повышенной восприимчивости рака (Li-Fraumeni). Возникновение злокачественных новообразований у несущих этот ген индивидуумов, происходит по аутосомно-доминантному типу, подобно семейной форме ретиноблатомы. Возникновение мутации дает 50% шанс развития одной из характерных для этого синдрома опухолей (рак грудной железы, саркома мягких тканей, остеосаркома, опухоли мозга или карцинома надпочечника) к возрасту 30 лет. Кроме того, у пациентов выживших после опухолей детского возраста могут развиваться вторичные новообразования, возникновение которых связано с мутациями.
Перспективные направления дальнейших исследований. Глубокое понимание клеточной и молекулярной биологии привело исследователей к разработке методов лечения и профилактики опухолей, путем замены дефектных генов их нормальными копиями, перемещением гена в опухолевые клетки или в клетки индивидуумов с генетическим предрасположением к раку. Возможно использование методов генной инженерии для вставки нормальной копии гена-супрессора в раковую клетку и возвращение ее к нормальному росту. Подобные эксперименты предложены для программирования смерти клетки (апоптоза). Введение антисмысловых фрагментов ДНК может быть эффективным с целью превращения клеток опухолевой культуры в клетки с нормальными характеристиками роста.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 662; Нарушение авторских прав?; Мы поможем в написании вашей работы!