
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства алкенов
|
|
|
|
В противоположность алканам алкены – очень реакционноспособные вещества. Х имические свойства алкенов связаны прежде всего с реакционной способностью двойной связи. Характерная особенность двойной связи – концентрация электронной плотности над- и под плоскостью расположения σ-связей (рис. 3). Распределение электронной плотности неравномерно, поэтому алкены склонны к реакциям электрофильного присоединения по двойной связи с восстановлением термодинамически более выгодной sp3-конфигурации углеродных атомов:

 | |
| |
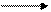

 C = C + A — B — C — C —
C = C + A — B — C — C —
ê ê
А В
Повышенная электронная плотность у атомов углерода при двойной связи притягивает соединения или частицы с дефицитом электронной плотности − электрофильные частицы.
2.3.1. Реакция галогенирования
При взаимодействии алкенов с галогенами образуются дигалогеналканы:
 CH2=CH2 + Br2 Br−CH2−CH2−Br
CH2=CH2 + Br2 Br−CH2−CH2−Br
1,2-дибромэтан
В этой реакции роль электрофильной частицы выполняет молекула галогена, поляризованная под воздействием повышенной электронной плотности двойной связи:
δ+ δ−
 Br — Br Br — Br
Br — Br Br — Br
Далее поляризованная молекула брома ориентируется около электронной плотности p-связи положительным полюсом, образуя p- комплекс:

p- комплекс
На следующей стадии происходит разрыв связи Вr—Br и p-комплекс превращается в σ- комплекс − карбокатион:
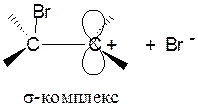
Реакция завершается присоединением аниона брома с получением 1,2-дибромэтана.
Аналогично бромируются и другие алкены:
 СН3−СН=СН2 + Br2 CH3− CH−CH2
СН3−СН=СН2 + Br2 CH3− CH−CH2
ê ê
Br Br 1,2-дибромпропан
Реакция бромирования алкенов сопровождается обесцвечиванием бромной воды и является качественной на двойную связь.
2.3.2. Реакция гидрогалогенирования
По электрофильному механизму протекает и присоединение по двойной связи галогеноводородов. Так, этилен при взаимодействии с хлороводородом превращается в хлорэтан:
 CH2=CH2 + HCl CH3−CH2Cl
CH2=CH2 + HCl CH3−CH2Cl
В случае несимметричных алкенов реакция гидрогалогенирования может протекать по двум направлениям:
 CH2Br−CH2−CH3
CH2Br−CH2−CH3
1-бромпропан

 CH2=CH−CH3 + HBr
CH2=CH−CH3 + HBr
CH3−CHBr−CH3
2-бромпропан
В реакции в значительной степени преобладает один из двух возможных продуктов, а именно 2-бромпропан.
Присоединение по двойной связи происходит по правилу Марковникова: водород присоединяется к атому углерода, связанному с наибольшим количеством водородных атомов.
2.3.3. Реакция гидратации (присоединение воды)
Реакция протекает в присутствии катализатора − серной кислоты. При этом в результате реакции из алкенов получают спирты. Например, из этилена реакцией гидратации получают этиловый спирт:
 CH2=CH2 + HOH CH3−CH2−OH
CH2=CH2 + HOH CH3−CH2−OH
В случае несимметричных алкенов гидратация протекает по правилу Марковникова
 CH2 = CH−CH3 + HOH CH3−CH−CH3
CH2 = CH−CH3 + HOH CH3−CH−CH3
пропен ê пропанол-2
OH
2.3.4. Реакция гидрирования
Реакция присоединения водорода по двойной связи протекает в присутствии катализатора (Ni, Pd, Pt) с образованием насыщенных соединений:
 CH2=CH2 + H2
CH2=CH2 + H2  CH3−CH3
CH3−CH3
этен этан
2.3.5. Реакция полимеризации
Разновидностью реакций присоединения являются и реакции полимеризации:
 n CH2=CHR (−CH2−CHR−)n
n CH2=CHR (−CH2−CHR−)n
Полимеризацией называется процесс, при котором небольшие молекулы реагируют друг с другом с образованием высокомолекулярного соединения. Число n называют степенью полимеризации.
Полимеризацией тетрафторэтилена получают тефлон :
 n CF2=CF2 (−CF2− CF2 −) n
n CF2=CF2 (−CF2− CF2 −) n
тетрафторэтилен тефлон
Поливинилхлорид получают полимеризацией хлорэтена (хлористого винила):
 n CH2=CHCl (−CH2−CH −) n
n CH2=CHCl (−CH2−CH −) n
хлорэтен | поливинилхлорид
Сl
2.3.6. Реакции окисления алкенов
Реакции окисления также затрагивают в первую очередь двойную связь. При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:
 3 CH2=CH2 + 2 KMnO4 + 4 H2O 3 HOCH2−CH2OH + 2 MnO2 + 2 KOH
3 CH2=CH2 + 2 KMnO4 + 4 H2O 3 HOCH2−CH2OH + 2 MnO2 + 2 KOH
этандиол-1,2 (этиленгликоль)
В результате реакции фиолетовый раствор перманганата калия обесцвечивается; эта реакция, как и реакция обесцвечивания бромной воды, является качественной на двойную связь.
Как и все другие углеводороды, алкены горят:
 CnH2n + 3n/2 O2 n CO2↑ + n H2O
CnH2n + 3n/2 O2 n CO2↑ + n H2O
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 430; Нарушение авторских прав?; Мы поможем в написании вашей работы!