
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические и химические свойства. Оксикислоты – кристаллические вещества, легко растворимые в воде
|
|
|
|
Оксикислоты – кристаллические вещества, легко растворимые в воде. Они плавятся при значительно более высоких температурах, чем соответствующие предельные кислоты, и лучше растворяются в воде. Причина этого – большее количество водородных связей между молекулами оксикислот.
Благодаря акцепторному действию ОН-группы оксикислоты обладают более выраженными кислотными свойствами:
CH3−CH2−COOH CH3−CH−COOH
|
OH
Т. пл. = −22ºС Т. пл. = 18ºС
pKa = 4,88 pKa = 3,87
Наличие в молекулах оксикислот карбоксильной и гидроксильной групп приводит к тому, что эти вещества вступают в реакции, свойственные как спиртам, так и кислотам. В то же время они обладают и специфическими свойствами.
1. Образование эфиров
Реакция этерификации может протекать как по карбоксильной, так и по гидроксильной группе:
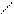

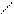
 O H2SO4 O
O H2SO4 O


 HO−CH2−C + C2H5OH HO−CH2−C + H2O
HO−CH2−C + C2H5OH HO−CH2−C + H2O
OH OC2H5
этиловый эфир гликолевой кислоты
O
||
 HO−CH2−COOH + (CH3CO)2O CH3−C−O−CH2−COOH + CH3COOH
HO−CH2−COOH + (CH3CO)2O CH3−C−O−CH2−COOH + CH3COOH
ацетилгликолевая кислота
2. Деструкция α-оксикислот
При нагревании с разбавленной серной кислотой α-оксикислоты распадаются до альдегидов и муравьиной кислоты:
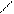
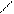 H2SO4 (разб.) O
H2SO4 (разб.) O

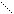 R−CH−COOH R−C + HCOOH
R−CH−COOH R−C + HCOOH
| H
OH
3. Дегидратация
Оксикислоты легко отщепляют воду, причем в зависимости от взаимного положения гидроксильной и карбоксильной групп образуются различные вещества.
α-оксикислоты при нагревании образуют циклические сложные эфиры – лактиды (от латинского названия молочной кислоты – acidum lacticum):
 | |||
 | |||
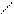


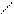

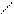


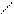
 R O−H HO O R O O
R O−H HO O R O O
 CH C CH C
CH C CH C
 | | | | + 2 H2O
| | | | + 2 H2O
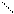


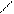
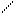


 C CH C CH
C CH C CH


 O OH H−O R O O R
O OH H−O R O O R
 | |||||
 |  | ||||
 2 H2O
2 H2O
H+ (OH−)
|
|
|
Обратная реакция – гидролиз лактидов – один из способов получения α-оксикислот.
β-оксикислоты при нагревании отщепляют воду, образуя непредельные кислоты:
 CH3−CH−CH2−COOH CH3−CH=CH−COOH + H2O
CH3−CH−CH2−COOH CH3−CH=CH−COOH + H2O
| β-оксимасляная кротоновая кислота
OH кислота
γ- и δ - оксикислоты в свободном состоянии очень неустойчивы (существуют в виде солей). При действии на эти соли сильных кислот они переходят в пяти- и шестичленные внутренние сложные эфиры – лактоны:

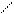
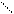
 CH2—CH2 − H2O CH2—CH2
CH2—CH2 − H2O CH2—CH2







 CH2 C=O CH2 C=O
CH2 C=O CH2 C=O
 O−H HO O
O−H HO O
γ-оксимасляная кислота лактон γ-оксимасляной кислоты
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 789; Нарушение авторских прав?; Мы поможем в написании вашей работы!