КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
На их основе
|
|
|
|
Лекция № 26-27 Моносахариды. Глюкоза и фруктоза. Строение. Свойства.
Лекция №24-25. Карбоновые кислоты. Состав и строение. Изомерия,
номенклатура. Свойства. Применение и получение………………………………………..138
Раздел 14. Сложные эфиры и жиры.
Лекция №26 Сложные эфиры. Жиры. Мыло и СМС………………………………………143
Раздел 15. Углеводы.
Дисахариды и полисахариды. Сравнение свойств крахмала и целлюлозы…………….149
Раздел 16. Амины и аминокислоты.
Лекция № 29 Амины. Состав. Строение. Свойства………………………………………….155
Лекция №30 Аминокислоты.Свойства.Получение. Применение....………………………159
Лекция № 31 Понятие о гетероциклических соединениях………………………………….161
Раздел 17. Белки. Нуклеиновые кислоты.
Лекция № 32-33 Белки. Нуклеиновые кислоты. Строение. Свойства. Применение……164
Раздел 18. Синтетические высокомолекулярные вещества и полимерные материалы
Лекция № 34 Основные понятия химии высокомолекулярных соединений……………171
Глоссарий.........................................................................................................................................175
Список использованной литературы.........................................................................................179
Пояснительная записка.
Предлагаемый сборник лекций предназначен для студентов, изучаемых химию в рамках общеобразовательной программы. Трудности, которые испытывают студенты при самостоятельной подготовке к занятия, обусловлены прежде всего отсутствием соответствующих навыков работы с дополнительной литературой, в использовании своих теоретических знаний при решении расчетных задач.
При подготовке сборника был учтен тот факт, что у студентов различный уровень знаний. Поэтому основная цель пособия- в доступной форме изложить единые теоретические концепции общей, неорганической и органической химии. Для облегчения поиска важнейших определений и понятий в сборнике приведен глоссарий. В конце каждой лекции даны вопросы для закрепления темы. Данное пособие написано в соответствии с типовой программой для профессионально-технического образования.
Лекция №1: Классификация неорганических веществ. Генетическая связь неорганических веществ.
Все вещества можно разделить на простые и сложные. Сложные неорганические вещества можно условно разделить на четыре важнейших класса: оксиды, основания, кислоты и соли. Приведенная классификация не охватывает, однако, всего многообразия неорганических веществ. Например, пероксиды, нитриды, карбиды и некоторые другие соединения не могут быть отнесены ни к одному из четырех классов. А такие вещества, как амфотерные гидроксиды (например: Zn(OH)2, Al(OH)3), имеют двойственный характер, проявляя кислотные и основные свойства. Основания, амфотерные гидроксиды и кислородсодержащие кислоты имеют сходство в строении, что позволяет объединить их общим понятием гидроксид, не нашедшим отражения в данной схеме.
Таким образом, приведенную классификацию неорганических соединений нельзя считать совершенной. Тем не менее, она облегчает изучение многочисленных неорганических веществ, так как принадлежность к определенному классу позволяет более обобщенно характеризовать их строение, химические свойства и способы получения.
Элементы
$
Вещества
' (
Простые Сложные & Основание
' ((((
Ме неМе Оксид Соль кислота
Оксидами называются сложные вещества, состоящие из двух элементов один из которых кислород. Оксидыделятся на основные, кислотные и амфотерные.
Кислотами называются вещества, состоящие из атомов водорода, способных замещаться на атомы металла и кислотного остатка. Кислоты бывают одноосновные, двуосновные и многоосновные. Основность определяется по количеству атомов водорода. Также кислоты делятся на кислородсодержащие и бескислородные.
Основаниями называются сложные вещества, состоящие из атомов металла и одной или нескольких гидроксильных групп. Основания делятся на растворимые и нерастворимые. По количеству гидрооксогруппы они бывают одноосновные, двуосновные и многоосновные.
Соли - это сложные вещества, состоящие из атомов металла и кислотного остатка. Соли делятся на кислые, основные и средние.
Единство и многообразие химических веществ наиболее ярко проявляется в генетической связи веществ, которая отражается в генетических рядах. Наиболее важными признаками генетических рядов являются:
1.Все вещества одного ряда должны быть образованы одним химическим элементом, например, Cl2  HCl
HCl  NaCl
NaCl  AgCl – генетический ряд хлора.
AgCl – генетический ряд хлора.
2.Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам химических веществ, например, в вышеприведенном ряду:
простое вещество  кислота
кислота  соль
соль  соль
соль
3.Вещества, образующие генетический ряд элемента, должны быть связаны между собой взаимопревращениями. Ряд называется полным, если он начинается и заканчивается простым веществом, и неполным, если заканчивается другим веществом, например, приведенный выше ряд неполный, а если добавить переход AgCl 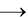 Cl2, ряд будет полным.
Cl2, ряд будет полным.
Генетическим называют ряд веществ – представителей разных классов неорганических соединений, являющихся соединениями одного и того же химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ.
Вопросы для закрепления темы:
1. Что называется сложным веществом?
2. Как подразделяются сложные вещества?
3. Какой ряд называется полным генетическим рядом?
4. Что называется генетической связью?
5. Как классифицируются оксиды?
6. Как классифицируются кислоты?
7. Как классифицируются соли?
8. Составьте генетический ряд натрия.
9. Составьте генетический ряд углерода.
Лекция №2: Типы химических связей
Химическая связь – совокупность сил, действующих между атомами или группой атомов. В результате действия этих сил образуются молекулы.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 1).
|
| Рисунок 1 Обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи |
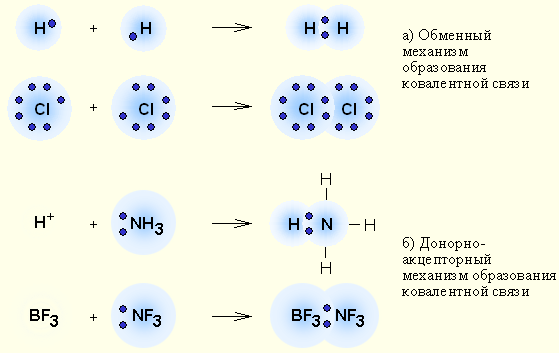
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
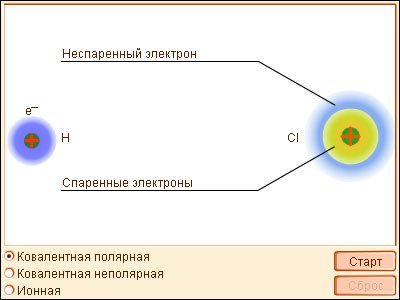
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA – χB)2, где χA и χB – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь пойдет ниже.
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.

|
| Модель 2. Виды химической связи |
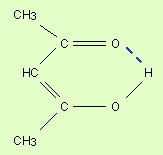
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
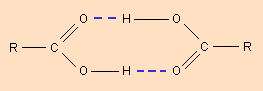
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3).
|
|
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 306,5 °C.

|
| Рисунок 4 Кварц – кристаллическая форма оксида кремния |
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Вопросы для закрепления:
1. Что называется химической связью?
2. Какие виды химической связи вы знаете?
3. За счет чего образуется ковалентная связь?
4. Какие виды ковалентной связи существуют?
5. Между какими элементами образуется ионная связь?
6. Для каких веществ характерна металлическая связь?
7. Что называется водородной связью?
8. Какой вид связи у следующих веществ: H2O, КCl, Са, раствор СН3СООН?
Лекция №3: Периодический закон Д.И.Менделеева. Строение электронных облаков. Значение закона.
Первый вариант Периодической таблицы элементов был опубликован Дмитрием Ивановичем Менделеевым в 1869 году - задолго до того, как было изучено строение атома. В это время Менделеев преподавал химию в Петербургском университете. Готовясь к лекциям, собирая материал для своего учебника "Основы химии", Д. И. Менделеев раздумывал над тем, как систематизировать материал таким образом, чтобы сведения о химических свойствах элементов не выглядели набором разрозненных фактов.
Ориентиром в этой работе Д. И. Менделееву послужили атомные массы (атомные веса) элементов. После Всемирного конгресса химиков в 1860 году, в работе которого участвовал и Д. И. Менделеев, проблема правильного определения атомных весов была постоянно в центре внимания многих ведущих химиков мира, в том числе и Д. И. Менделеева.
Располагая элементы в порядке возрастания их атомных весов, Д. И. Менделеев обнаружил фундаментальный закон природы, который теперь известен как Периодический закон:
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 644; Нарушение авторских прав?; Мы поможем в написании вашей работы!