
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура
|
|
|
|
C2H5-NH2 CH3-NH-C2H5 (CH3)3N
этиламин метилэтиламин триметиламин
По другой системе названия первичных аминов строят, исходя из названия родоначального углеводорода и добавляя окончание -амин с указанием номера атома углерода, связанного с аминогруппой.
Физические свойства. Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда - жидкости, высшие — твердые вещества. Между молекулами аминов в жидкой фазе образуются слабые водородные связи, поэтому температуры кипения аминов выше, чем у соответствующих углеводородов.
Амины также образуют слабые водородные связи с водой, поэтому низшие амины хорошо растворимы в воде, по мере роста углеродного скелета растворимость в воде уменьшается. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Химические свойства.
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак.
Водные растворы аминов имеют щелочную реакцию:
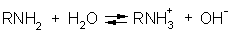
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли, которые являются аналогами солей аммония:
CH3NH2 + H2SO4 → [CH3NH3]HSO4,
C6H5NH2 + HCl → [C6H5NH3]Cl.
Соли аминов — твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи превращают соли аминов в свободные амины подобно тому, как из солей аммония щелочи вытесняют аммиак.
[CH3NH3]Cl + NaOH→ CH3NH2↑ + NaCl + Н2О.
2. Амины — органические аналоги аммиака, поэтому они могут образовывать комплексные соединения с переходными металлами:
Сu2+ + 4CH3NH2 = [Cu(NH2CH3)4]2+.
Неподеленная пара электронов амина в этих комплексах занимает свободную орбиталь во внешнем слое центрального атома, образуя донорно-акцепторную связь.
3. Первичные и вторичные амины реагируют с азотистой кислотой, образующейся при добавлении нитрита натрия к разбавленной соляной кислоте:
NaNO2 + HCl → HNO2 + NaCl.
Первичные амины под действием азотистой кислоты превращаются в спирты:
RNH2 + HNO2 → ROH + N2↑ + H2O.
Промежуточным соединением в этой реакции является неустойчивый ион диазония [R-N≡N]+.
Вторичные амины с азотистой кислотой дают N-нитрозамины — маслянистые жидкости с характерным запахом:
R2NH + HO-N=O → R2N-N=O + Н2О.
Третичные алифатические амины с азотистой кислотой не реагируют. Таким образом, азотистая кислота — реагент, позволяющий определять тип амина.
4. При сгорании аминов образуются углекислый газ, азот и вода:
4CnH2n+3N + (6n+3)O2 = 2N2 + 4nCO2 + (4n+6)Н2О
Получение. 1. Основной способ получения аминов — алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком под давлением:
СН3Сl + 2NН3 → CH3NH2 + NH4Cl.
При избытке алкилгалогенида полученный первичный амин также может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин, например:
СН3Сl + CH3NH2 → (СН3)2NН2+Сl-,
2CH3Cl + CH3NH2 → (CH3)3NH+Cl- + HCl.
Практически в таких реакциях получается смесь солей первичного, вторичного и третичного аминов, из которой амины выделяют под действием щелочи и разделяют путем перегонки.
2. Первичные амины также получают восстановлением нитросоединений по схеме:
RNO2 + 6[Н] → RNH2 + 2Н2О.
Для восстановления используют сульфид аммония (реакция Зинина), цинк или железо в кислой среде, алюминий в щелочной среде или непосредственно водород в газовой фазе.
3. Первичные амины можно получать восстановлением нитрилов:
R-C≡N + 4[Н] → R-CH2-NH2.
В качестве восстановителя используют алюмогидрид лития LiAlH4.
4. В биологических системах может происходить ферментативное декарбоксилирование аминокислот:

Применение. Низшие алифатические амины используются для синтеза лекарственных средств, пестицидов и пластмасс.
Вопросы для закрепления темы:
1. Что собой представляют амины?
2. Как классифицируются амины?
3. Какими свойствами обладают амины?
4. Какие способы получения аминов вы знаете?
5. Какие физические свойства характерны для аминов?
6. Где применяются амины?
7. Какова общая формула предельных алифатических аминов?
Лекция № 30: Аминокислоты. Свойства, получение, применение.
Аминокислоты - это органические бифункциональные соединения, в состав которых входят карбоксильная группа -СООН и аминогруппа -NН2. В зависимости от взаимного расположения обеих функциональных групп различают α-, β-, γ-аминокислоты:
β α β α

α-аминопропионовая β-аминопропионовая
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Здесь будут рассматриваться только α-аминокислоты, поскольку другие аминокислоты в природе не встречаются.
В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия.
Изомерия. Во всех α-аминокислотах, кроме глицина, α-углеродный атом связан с четырьмя разными заместителями, поэтому все эти аминокислоты могут существовать в виде двух изомеров (энантиомеров), являющихся зеркальными отражениями друг друга (оптическая изомерия). Каждый изомер относят к D- или L-ряду в зависимости от того, совпадает его конфигурация с конфигурацией D-глицеринового альдегида или нет:
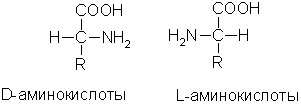
В состав белков животных организмов входят только L-аминокислоты.
Физические свойства. Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус.
Химические свойства. Аминокислоты - это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н2N-СН2-СООН + HCl→ Сl[Н3N-СН2-СООН],
Н2N-СН2-СООН + NaOH → H2N-CH2-COONa + Н2О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H2N-CH2—СООН → +Н3N-СН2—СОO-.
Важнейшее свойство аминокислот — их способность к конденсации с образованием пептидов.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 385; Нарушение авторских прав?; Мы поможем в написании вашей работы!