
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 2. Строение атома
|
|
|
|
План
1. Модели строения атома.
2. Атомная орбиталь.
3. Квантовые числа.
4. Распределение электронов в многоэлектронных атомах.
5. Ядро атома.
1. Гипотеза Дж. Томсона. Одна из первых моделей строения атома была предложена Дж. Томсоном в 1913 г. Атом представлялся как “сфера положительного электричества” одинаковой плотности по всему объему диаметром 0,1 нм. Электроны как бы плавают в этой сфере, нейтрализуя положительный заряд.
Планетарная модель Э. Резерфорда. Для проверки гипотезы Дж. Томсона, Э. Резерфорд провел серию опытов по рассеиванию α-частиц (ядра атома гелия). Суть планетарной модели Э. Резерфорда (1911) можно свести к следующим положениям:
1. в центре атома находится положительно заряженное ядро;
2. весь положительный заряд и почти вся масса атома сосредоточена в ядре;
3. вкруг ядра вращаются электроны.
Строение атома по Н. Бору. В 1913 году Н. Бор основываясь на планетарной модели строения атома Э. Резерфорда и теории М. Планка предложил свою гипотезу строения атома, которую сформулировал в виде постулатов:
1. электрон может вращаться вокруг ядра не по произвольным, а по строго определенным (стационарным) круговым орбитам;
2. двигаясь по стационарной орбите электрон не излучает и не поглощает энергии;
3. излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
Квантово-механическая модель строения атома. В 1924 году Луи де Бройль высказал предположение, что электрон характеризуется корпускулярно-волновым дуализмом (обладает свойствами волны и частицы). В 1927 году В. Гейзенберг сформулировал принцип неопределенности, согласно которому положение и скорость движения микрочастицы невозможно определить с абсолютной точность в любой момент времени.
2. Вероятность нахождения электрона в определенной области пространства вокруг ядра описывается волновой функцией 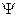 (пси). В соответствии с определением
(пси). В соответствии с определением 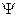 орбиталью называется область околоядерного пространства, в котором наиболее вероятно нахождение электрона. Так как электрон несет отрицательный заряд, то его орбиталь представляет собой распределение заряда, которое получило название электронного облака. Под электронным облаком понимают область пространства вблизи ядра атома, в которомсосредоточено до 90 % заряда и массы электрона. Это означает, что 90 % времени электрон находится в этой части пространства.
орбиталью называется область околоядерного пространства, в котором наиболее вероятно нахождение электрона. Так как электрон несет отрицательный заряд, то его орбиталь представляет собой распределение заряда, которое получило название электронного облака. Под электронным облаком понимают область пространства вблизи ядра атома, в которомсосредоточено до 90 % заряда и массы электрона. Это означает, что 90 % времени электрон находится в этой части пространства.
3. Вся совокупность движений электрона в атоме описывается квантовыми числами: главным, орбитальным, магнитным и спиновым. Главное квантовое число (n) определяет общую энергию и размеры электронных орбиталей. Оно может принимать любые целые значения, начиная с единицы (n = 1, 2, 3…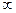 ). Орбитальное квантовое число (l) характеризует форму электронной орбитали. Оно может принимать целые значения от 0 до n- 1. Орбитали с l = 0 называют s-орбитали, l = 1- р-орбитали, l = 2 –d-орбитали, l = 3 – f- орбитали. Магнитное квантовое число (ml) характеризует ориентацию орбитали в пространстве. Оно может принимать целые значения от – l до + l, включая 0. Спиновое квантовое число (ms) характеризует собственный момент импульса электрона, которому характерно вращение вокруг собственной оси. Каждый электрон может совершать такое вращение в одном из двух противоположных направлениях. Поэтому ms принимает два значения: + ½ и – ½.
). Орбитальное квантовое число (l) характеризует форму электронной орбитали. Оно может принимать целые значения от 0 до n- 1. Орбитали с l = 0 называют s-орбитали, l = 1- р-орбитали, l = 2 –d-орбитали, l = 3 – f- орбитали. Магнитное квантовое число (ml) характеризует ориентацию орбитали в пространстве. Оно может принимать целые значения от – l до + l, включая 0. Спиновое квантовое число (ms) характеризует собственный момент импульса электрона, которому характерно вращение вокруг собственной оси. Каждый электрон может совершать такое вращение в одном из двух противоположных направлениях. Поэтому ms принимает два значения: + ½ и – ½.
4. Распределение электронов в многоэлектронных атомах основано на следующих основных положениях: принципе минимума энергии, правиле В. Клечковского, принципе В. Паули и правиле Ф. Хунда.
Принцип минимума энергии. Согласно этому принципу электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей. Первыми заполняются орбитали с минимальными уровнями энергии.
Правило В. Клечковского. Электрон обладает наинизшей энергией на той электронной подоболочке, где сумма квантовых числе n и l минимальна. Если сумма n + l одинакова для рассматриваемых электронных подоболочек, то используют второе правило В. Клечковского. Электрон обладает наинизшей энергией на подоболочке с наименьшим значением главного квантового числа.
Принцип В. Паули. Состоит в том, что в атоме не может быть двух электронов у которых все четыре квантовые числа были одинаковы. Отсюда следует, что на каждой орбитали может быть не более двух электронов, причем они должны иметь противоположные (антипараллельные) спины.
Правило Ф. Хунда. В наиболее устойчивом состоянии атома электроны размещаются в пределах элуктронной подоболочки так, чтобы их суммарный спин был максимален.
5. Ядро атома – это положительно-заряженная часть атома, в которой сосредоточена почти вся масса атома. Радиус ядра составляет 10-13 см. Ядро состоит из элементарных частиц двух типов – протонов и нейтронов. Общее их понятие – нуклоны. Сумма числа протонов и числа нейтронов, содержащихся в ядре атома называется массовым числом атома (А). Заряд ядра равен порядковому номеру химического элемента и числу протонов. Разновидности атомов с одинаковым зарядом ядра, но с разными массовыми числами называют изотопами (например, кислород имеет три изотопа).
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1039; Нарушение авторских прав?; Мы поможем в написании вашей работы!