
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй постулат Н. Бора
|
|
|
|
Первый постулат Н. Бора
Система квантовых чисел
В атоме водорода существуют стационарные орбиты, вращаясь по которым электрон не излучает и не поглощает энергию.
Н. Бор рассчитал радиусы стационарных орбит с помощью главного квантового числа.
n – главное квантовое число, n = 1,2,3,4,...+ ∞.
Вращаясь по стационарным орбитам, электроны обладают определённым запасом потенциальной энергии
| n1 = 1 | r2 = 0,53 А0 | Е = -13,6. 1/n2 эВ, |
| n1 = 2 | r2 = 2,12 А0 | где n-главное квантовое число. |
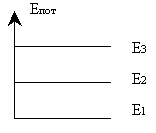
| по мере удаления от ядра потенциальная энергия электронов возрастает. |
Стационарные орбиты называются энергетическими уровнями.
Со временем на основании принципа неопределённости отказались от понятия плоских орбит, предложенных Бором, и перешли к понятию электронного облака, или орбитали.
Орбиталь (электронное облако) – это наиболее вероятное местонахождение электрона в каком-то объёме околоядерного пространства. За пределами этого пространства вероятность встретить электрон достаточно мала (менее 5%).
Радиусы орбиталей имеют значения, рассчитанные Бором для стационарных орбит.
Главное квантовое число имеет две функции:
· определяет размер электронного облака;
· определяет его энергетический запас.
Следующее квантовое число – орбитальное. Орбитальное число отвечает значению орбитального момента количества движения электрона.
l – орбитальное квантовое число. Оно тесно связано с главным и принимает значения 0…(n-1).
| n | l |
| 0(S) | |
| 0(S) 1(p) | |
| 0(S) 1(p) 2(d) | |
| 0(S) 1(p) 2(d)3(f) |
Орбитальное квантовое число характеризует энергетические подуровни в электронной оболочке атома.
Орбитальное квантовое число определяет конфигурацию подуровней. Согласно квантовомеханическим расчётам
S-орбитали имеют форму шара,
p-орбитали - форму гантели,
d- и f-орбитали - более сложные формы.
На одном уровне энергия подуровней возрастает в ряду:
ES < E p< Ed< Ef.
В атоме возникают магнитные поля, которые ориентируют подуровни в пространстве строго определённым образом.
Магнитное квантовое число принимает значение целых чисел: -l...0...+l.
| l | mI | |
| значение | количество | |
| 0(S) | ||
| 1(p) | -1...+1 | |
| 2(d) | -2, …+2 | |
| 3(f) | -3, …+3 |
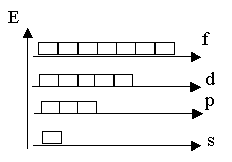
| s – подуровень выражен единожды; p - подуровень выражен троекратно; d - подуровень выражен пятикратно; f - подуровень выражен семикратно. |
Для описания орбиталей используются три квантовых числа n, l, ml.
Четвёртое квантовое число - спиновое - описывает собственный момент количества движения электрона и принимает значения:
S = ± 1/2.
Электроны могут вращаться только в двух взаимопротивоположных направлениях, условно обозначаемых
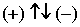 .
.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 324; Нарушение авторских прав?; Мы поможем в написании вашей работы!