
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая активность. Ионная сила раствора
|
|
|
|
Степень диссоциации. Константа электролитической диссоциации
Рассмотрим количественные зависимости процесса диссоциации на примере водных растворов слабых кислот.
В водных растворах слабых электролитов происходит как процесс диссоциации, так и ассоциации молекул и ионов. По мере увеличения количества свободных ионов в растворе растет скорость образования молекул. В какой-то момент времени наступает равновесие: v1 = v2
при этом относительное количество недиссоциированных молекул и ионов остаются постоянными и характеризуются степенью электролитической диссоциации: a = Сд/Соб
Степень электролитической диссоциации a представляет собой отношения числа моль вещества диссоциированного на ионы (Сд) к общему числу моль растворенного вещества (С об).
Например, в 0,1 М растворе степень диссоциации уксусной кислоты aСН3СООН = 0,013, то есть 1,3% всех молекул распадается на ионы; aKCI = 0,86 - для 0,1 М раствора; - 0,94 для 0,01 М раствора.
Сильные электролиты: α >30%; слабые α <3%; средние α -30% - 3%.
Рассмотрим процесс диссоциации слабого электролита:
НА ↔ Н+ + А-;
В состоянии равновесия при v1 = v2, соответственно закону действия масс:
К = [Н+][А-] / [НА],
где K - константа диссоциации электролита - характеризует склонность к ионизации. Чем больше К, тем выше концентрация ионов в растворе.
Величина К для растворов слабых электролитов - есть постоянной при постоянных Р и t.
Пример: для одноосновной уксусной кислоты
CH3COOН «СН3СОО- + H+ , К = 1,8×10-5
Многоосновные кислоты диссоциируют по каждой ступени:
Н2СО3 «Н+ + НСО3- К1 = 4×10-7
НСО3- «Н+ + СО32- К2 = 4×10-11
Первая константа намного больше второй. Это говорит о том, что двухосновная кислота диссоциирует по первой ступени сильнее, чем по второй, или для нашего случая: Н2СО3 намного сильнее НСО3-.
Между степенью диссоциации a и const диссоциации К существует определенная зависимость. Рассмотрим диссоциацию бинарного электролита, который распадается на 2 иона:
НА ↔ Н+ + А-
Обозначим С = Соб, тогда a = Сдис/Соб. В соответствии с уравнением диссоциации:
[H+] = [A-] = C × a; [AH] = С - a × С = С(1 - a);
Запишем закон действующих масс для полученных величин:
К = αС.αС / С(1 - α);
Таким образом константа диссоциации равняется:
К = α2С / (1 – α);
Это выражение носит название – закон разведения Оствальда, который устанавливает зависимость между a и концентрацией слабого электролита.
Если учесть, что для слабых электролитов a<<1, то:
К = a2 × С;
a = √К/С);
то есть чем ниже концентрация, тем выше a- степень диссоциации, а, следовательно, и электропроводимость растворов.
Закон действия масс можно применять для слабых электролитов. Для сильных – возникает большая ошибка.
Для точных расчетов на основе закона действия масс пользуются величиной химической активности. Эта величина введена для учета взаимного притяжения и отталкивания ионов, взаимодействия растворимого вещества с растворителем и других явлений, которые изменяют подвижность ионов и которые не учитываются теорией электролитической диссоциации.
Активность (обозначается аі) можно рассматривать как величина, которая характеризует степень связанности частиц электролита.
Т.о., активность есть действующей концентрацией, которая проявляет себя в химических процессах в качестве реально действующей массы, в отличие от общей концентрации вещества в растворе.
Численно а равняется концентрации, умноженной на коэффициент активности f і: а = f . C.
Коэффициент активности является величиной, отражающей все явления, которые вызовают изменение подвижности ионов.
В разбавленном растворе f = 1 и а = С.
В реальных условиях f < 1 и а < С.
Подстановка величин активностей вместо значений концентрации в уравнение закона действия масс, делает эти уравнения применимыми к реальным растворам сильных электролитов.
Так константа диссоциации соединения НА равняется:
КНА = а Н+. а А- / а НА.
Константы диссоциации, определенные с помощью активностей, называются истинными или термодинамическими константами диссоциации.
Коэффициент активности зависит не только от концентрации данного электролита, но также и от концентраций других ионов, присутствующих в растворе.
Мерой взаимодействия между всеми ионами в растворе есть ионная сила раствора - величина, которая зависит от концентрации и заряда ионов, присутствующих в растворе.
Ионная сила m равняется полусумме произведений концентраций ионов на квадраты их зарядов:
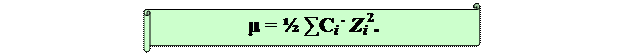
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 860; Нарушение авторских прав?; Мы поможем в написании вашей работы!