
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественный анализ
|
|
|
|
Кислотно-щелочная классификация анионов
Кислотно-основная классификация катионов
Например,
1) Для открытия иона кобальта несколько кристалликов СоСl2 растирают с кристаллами NH4CNS:
СоСl2 + 4 NH4CNS = (NH4)2 [Со (CNS)4] + 2 NH4Cl
Смесь синеет (тетрароданидокобальтат аммония)
2) При открытии иона Fe+3 соль трехвалентного железа растирают с NH4CNS. При этом происходит реакция образования роданида железа темно-красного цвета по уравнению реакции:
FeCl3 + 3 NH4CNS = Fe(CNS)3 + 3 NH4Cl
3) Для открытия иона хрома соль трехвалентного хрома растирают с перекисью натрия, в результате образуется хромат натрия желтого цвета:
2 CrCl3 + 3Na2O2 + 2H2O = 2 Na2CrO4 + 2 NaCl + 4 HCl
4) Для открытия аниона СН3СОО- кристаллик твердой соли уксусной кислоты растирают с небольшим количеством твердого NaHSO4 или KHSO4. Выделяющаяся свободная уксусная кислота узнается по запаху:
CH3COONa + NaHSO4 = Na2SO4 + CH3COOH.
В качественном анализе реакции сухим путем играют вспомогательную роль; ими пользуются обычно в качестве предварительных испытаний.
«МОКРЫЙ МЕТОД»
Большинство аналитических реакций недостаточно специфичны и дают сходный эффект с несколькими ионами. Поэтому в процессе анализа приходится прибегать к отделению ионов друг от друга. Таким образом, открытие ионов проводится в определенной последовательности. Последовательное разделение ионов и их открытие носит название систематического хода анализа (в отличие от дробного). При систематическом ходе анализа катионов последние отделяются не поодиночке, а сразу целыми группами.
Реактивы, осаждающие целую группу катионов называются групповыми реактивами или реагентами.
В систематическом анализе катионы и анионы делят на аналитические группы. Аналитическая группа — это группа катионов, которая с определенным реактивом (при определенных условиях) дает подобные аналитические реакции.
Существует несколько классификаций катионов: сульфидная, кислотно-щелочная, аммиачно-фосфатная. Мы остановимся на кислотно-щелочной.
В кислотно-щелочной системе анализа катионов использованы основные свойства элементов: отношение их к кислотам и щелочам, амфотерность гидроксидов и способность элементов к комплексообразованию.
В кислотно-щелочной системе анализа катионов катионы делятся на 6 групп:
1-я группа: (катионы щелочных металлов) –
Na+, K+, Li+, Cs+, Rb+, NH4+. Не имеет группового реагента; катионы этой группы не осаждаются ни минеральными кислотами, ни щелочами.
2-я группа: Ag+, Pb+2, Hg2+2 - осаждаются соляной кислотой.
3-я группа: (щелочноземельные) – Ca+2, Ba+2, Sr+2 - осаждаются сульфатной кислотой.
4-я группа: Al+3, Cr+3, Zn+2 - не выпадают в осадок при добавлении избытка щелочи.
5-я группа: Fe+2, Fe+3, Mn+2 - осаждаются раствором щелочи.
6-я группа: Cu+2, Ni+2, Co+2, Hg+2, Cd+2 - образуют гидроксиды, растворимые в избытке 25 % - ного раствора аммиака (получаются аммиакаты).
Таблица 1 Кислотно-основная классификация катионов
| Аналитические группы | ||||||
| I | II | III | IV | V | VI | |
| Катионы | Li+, Na+, K+, Rb+, Cs+, NH4+ | Ag+, Pb2+, Hg22+ | Ba2+, Ca2+, Sr2+ | Al3+, Cr3+, Zn2+ | Mn2+, Fe2+, Fe3+, | Cu2+, Ni2+, Co2+, Hg2+, Cd2+ |
| Групповой реагент | Нет | HCl (2н) | H2SO4 (2н) | NaOH | NaOH, NH4OH | NH4OH |
| Характер получае-мых соединений | ––– | MeCl, MeCl2 Нераство-римы в кислотах | MeSО4 Нераст-воримы в кислотах и щелочах | Ме(ОН)n Растворимы в избытке NaOH | Ме(ОН)n Нерастворимы в избытке NaOH | Ме(ОН)2 Растворимы в избытке NH4OH |
Анионы тоже делят на группы. Групповыми реактивами являются хлорид бария и нитрат серебра. В отличие от катионов, анионы не мешают выявлению друг друга. Групповые реагенты используют для предварительного выявления группы.
В основу классификации анионов положена разная растворимость солей бария и аргентума. Все анионы можно поделить на три аналитические группы (табл.2).
К первой аналитической группе анионов относятся анионы: SO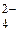 , CO
, CO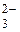 , PO
, PO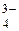 , SO32-, SiО32-, CrО42-, MnО4- и т.п. Эти анионы образовывают с катионом Ва
, SO32-, SiО32-, CrО42-, MnО4- и т.п. Эти анионы образовывают с катионом Ва соли, которые мало растворяются в воде, но за исключением сульфата бария, хорошо растворяются в разбавленных минеральных кислотах. Поэтому выделять анионы этой группы в виде осадков групповым реагентом – хлоридом бария – можно только в нейтральной или слабощелочной среде. Анионы первой аналитической группы образуют с катионами аргентума соли, которые растворяются в разбавленной нитратной кислоте, а сульфат аргентума растворяется даже в воде.
соли, которые мало растворяются в воде, но за исключением сульфата бария, хорошо растворяются в разбавленных минеральных кислотах. Поэтому выделять анионы этой группы в виде осадков групповым реагентом – хлоридом бария – можно только в нейтральной или слабощелочной среде. Анионы первой аналитической группы образуют с катионами аргентума соли, которые растворяются в разбавленной нитратной кислоте, а сульфат аргентума растворяется даже в воде.
Ко второй аналитической группе анионов относятся ионы CI , Вr
, Вr , I
, I , S2-, SCN- и т.п. Эти анионы образовывают с катионами Ag
, S2-, SCN- и т.п. Эти анионы образовывают с катионами Ag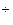 соли, которые не растворяются в воде и разбавленной нитратной кислоте. Групповым реагентом второй группы анионов есть нитрат аргентума в присутствии нитратной кислоты (в этих условиях анионы первой группы не дают осадка с анионами Ag
соли, которые не растворяются в воде и разбавленной нитратной кислоте. Групповым реагентом второй группы анионов есть нитрат аргентума в присутствии нитратной кислоты (в этих условиях анионы первой группы не дают осадка с анионами Ag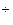 ). Хлорид бария с анионами второй группы осадков не дает.
). Хлорид бария с анионами второй группы осадков не дает.
К третьей группе анионов относятся ионы NO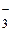 , CH
, CH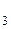 COO
COO , NO2- и т.п. Катионы Бария Ba
, NO2- и т.п. Катионы Бария Ba и Аргентума Ag
и Аргентума Ag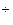 с анионами данной группы не образовывают осадков, группового реагента на ионы третьей группы нет.
с анионами данной группы не образовывают осадков, группового реагента на ионы третьей группы нет.
Таблица 2 Классификация анионов
| Группа | |||
| I | II | III | |
| Анионы | SO42–, SO32–, S2O32–, CO32–, PO43–, B4O72– и др. | Cl–, Br–, J–, S-2 и др. | NO3–, NO2–, CH3COO– и др. |
| Групповой реагент | BaCl2 в нейтральной или слабощелочной среде | AgNO3 | Hет |
| Характер получае-мых соединений | 1) Осадки солей бария растворимы в кислотах (кроме ВаSO4) 2) Осадки солей серебра растворимы в НNО3 (разб.) | Осадки солей серебра нерастворимы в воде и НNО3 (разб.) | Осадки солей бария и серебра растворимы в воде |
Дробными реакциями называются такие реакции, при помощи которых можно обнаружить интересующий нас ион в присутствии других ионов.
Дробное открытие ионов производится в два приема: сначала путем подходящих реакций выделяют определяемый ион или же маскируют ионы, мешающие его открытию, а затем с помощью характерной реакции убеждаются в присутствии определяемого иона.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 826; Нарушение авторских прав?; Мы поможем в написании вашей работы!