
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Углерод
|
|
|
|
ОРГАНИКА
МОДУЛЬ 3.
Лекция 4.
Основные понятия органической химии. Насыщенные углеводороды: свойства, применение и методы анализа.
Основным элементом, входящим в состав органических соединений, является углерод. Поэтому А.М. Бутлеров определил органическую химию как химию соединений углерода. Однако существуют простые вещества, содержащие углерод (СО; СО2; СS2, соли синильной кислоты и др.), которые относят к неорганическим соединениям и изучают в курсе общей или неорганической химии. Учитывая это, более точно органическую химию следует определять как химию углеводородов и их производных, в состав которых могут входить почти все элементы периодической системы.
Символ С, элемент IVA группы 2-го периода периодической системы элементов атомный номер 6; атомная масса 12,01115.
Электронная конфигурация в основном состоянии 1 s 22 s 22 p 2.
Углерод - особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многобразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения: открытые (неразветвленные, разветвленные), замкнутые:
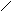
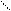 | | | | | | |
| | | | | | |
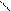
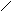 -c-c-c-c- -c-c-c- c
-c-c-c-c- -c-c-c- c
| | | | | | |
-c- >c c <
| | |
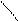
 c c <
c c <

 c
c
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи: > С = С < - С = С - -С=С-С=С-
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
· наличие на внешнем энергетическом уровне (2 s и 2 p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов) и четырехвалентных орбиталей;
· малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 475; Нарушение авторских прав?; Мы поможем в написании вашей работы!