
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод молекулярных орбиталей
|
|
|
|
Большей предсказательной силой обладает метод молекулярных орбиталей (МО). В нем молекула рассматривается как единая система ядер и электронов. Последние находятся в общем пользовании всех ядер атомов, образующих молекулу. Таким образом, метод МО химическую связь рассматривает как многоцентровую и многоэлектронную. В этом случае для приближенного решения уравнения Шредингера волновая функция, соответствующая молекулярной орбитали, задается как линейная комбинация атомных орбиталей, т. е. как сумма и разность атомных волновых функций с коэффициентами, указывающими на долю их вклада в образование молекулярной орбитали:
Y+ = c 1Y1 + c 2Y2,
Y– = c 3Y1 – c 4Y2.
Полученный метод получил название линейной комбинации атомных орбиталей (ЛКАО-МО).
В методе ЛКАО МО для образования устойчивой молекулярной орбитали необходимо, чтобы энергии атомных орбиталей были близки друг к другу. Кроме того, нужно, чтобы их симметрия не сильно отличалась. При выполнении этих двух требований коэффициенты c 1 и c 2 должны быть близкими по своим значениям, а это, в свою очередь, обеспечивает максимальное перекрывание электронных облаков. При сложении атомных орбиталей образуется молекулярная орбиталь, энергия которой понижается относительно энергий атомных орбиталей. Такая молекулярная орбиталь называется связывающей. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между ядрами, и волновая функция принимает положительное значение. При вычитании атомных орбиталей энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей. Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки, что хорошо видно из схемы образования связывающей и разрыхляющей орбиталей, приведенной на рис. 16:
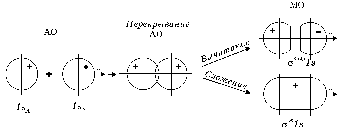
Рис. 16. Схема образования связывающей
и разрыхляющей молекулярных орбиталей.
Когда атомная орбиталь одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных орбиталей молекулы с энергией, соответствующей ей в атоме. Орбиталь этого типа называется несвязывающей.
Классификация орбиталей на s или p производится в соответствии с симметрией их электронных облаков аналогично s- и p-связям в методе валентных связей: s-орбиталь имеет такую симметрию электронного облака, при которой поворот ее вокруг оси, соединяющей ядра, на 180° приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае же p-орбитали при повороте ее на 180° знак волновой функции меняется на противоположный. Отсюда следует, что s -электроны атомов при взаимодействии между собой могут образовывать только s-орбитали, а три (шесть) p -орбитали атома – одну s- и две p-орбитали, причем s-орбиталь возникает при взаимодействии p X атомных орбиталей, а p-орбиталь – при взаимодействии p Y и p Z. Молекулярные p-орбитали повернуты относительно межъядерной оси на 90°. Здесь наблюдается полная аналогия с методом валентных связей.


Рис. 17. Схема образования связывающих и разрыхляющих орбиталей
для 2р-атомных орбиталей.
Для того чтобы отличать связывающие и разрыхляющие орбитали друг от друга, а также их происхождение, принята следующая система обозначений. Связывающая орбиталь обозначается сокращением «св», располагающимся справа вверху после греческой буквы, обозначающей орбиталь, а разрыхляющая – соответственно «разр». Принято еще одно обозначение: звездочкой помечаются разрыхляющие орбитали, а без звездочки – связывающие. После обозначения молекулярной орбитали пишется обозначение атомной орбитали, которой молекулярная обязана своим происхождением, например, pразр2 p y. Это означает, что молекулярная орбиталь p-типа, разрыхляющая, образовалась при взаимодействии 2 p y-атомных орбиталей(см. рис. 17):
При рассмотрении электронного строения молекулы с точки зрения метода молекулярных орбиталей (МО) нужно руководствоваться следующими правилами:
1. Электроны в молекуле, как и в атоме, занимают соответствующие орбитали, которые характеризуются своим набором квантовых чисел;
2. Число образующихся молекулярных орбиталей равно числу атомных орбиталей участвующих в их образовании;
3. Распределение электронов по молекулярным орбиталям, так же как и в атоме, подчиняется принципу наименьшей энергии, принципу Паули и правилу Хунда;
4. Для молекул, образованных атомами одного химического элемента (гомоядерных), выигрыш в энергии за счет образования связывающей орбитали компенсируется повышением энергии разрыхляющей орбитали. На энергетической диаграмме обе орбитали располагаются симметрично относительно атомных орбиталей (см. рис. 18):

Рис. 18. Энергетическая диаграмма молекулярных орбиталей
для гомоядерных молекул (на примере молекулы водорода)
5. В гетероядерных (разноэлементных) молекулах связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома (B), а разрыхляющие – ближе к орбитали менее электроотрицательного атома (A). Разность в энергиях исходных атомных орбиталей (b) равна полярности связи. Эта разность является мерой ионности связи, а разность в энергиях между связывающей орбиталью и атомной орбиталью более электроотрицательного атома определяет ковалентность связи. (см. рис. 19):

Рис. 19. Энергетическая диаграмма молекулярных орбиталей
для гетероядерной молекулы.
6. Кратность химической связи равна половине разности числа электронов, расположенных на связывающих орбиталях, и числа электронов на разрыхляющих.
Для примера разберем энергетические диаграммы и электронное строение гетероядерных и гомоядерных молекул и ионов, образованных двумя атомами элементов первого и второго периодов Периодической системы.
У элементов первого периода валентной орбиталью является 1 s -орбиталь. Эти две атомных орбитали образуют две d-молекулярные орбитали – связывающую и разрыхляющую. Рассмотрим электронное строение молекулярного иона  . Он имеет один электрон, который будет занимать более энергетически выгодную s -связывающую орбиталь. В соответствии с правилом подсчета кратности связи она будет равна 0,5, а так как в ионе имеется один неспаренный электрон,
. Он имеет один электрон, который будет занимать более энергетически выгодную s -связывающую орбиталь. В соответствии с правилом подсчета кратности связи она будет равна 0,5, а так как в ионе имеется один неспаренный электрон,  будет обладать парамагнитными свойствами. Электронное строение этого иона запишется по аналогии с электронным строением атома так: sсв1 s 1. Появление второго электрона на s -связывающей орбитали приведет к энергетической диаграмме, описывающей молекулу водорода, возрастанию кратности связи до единицы и диамагнитным свойствам. Возрастание кратности связи повлечет за собой и увеличение энергии диссоциации молекулы H2 и более короткому межъядерному расстоянию по сравнению с аналогичной величиной у иона водорода. Электронное строение H2 можно записать так: sсв1 s 2.
будет обладать парамагнитными свойствами. Электронное строение этого иона запишется по аналогии с электронным строением атома так: sсв1 s 1. Появление второго электрона на s -связывающей орбитали приведет к энергетической диаграмме, описывающей молекулу водорода, возрастанию кратности связи до единицы и диамагнитным свойствам. Возрастание кратности связи повлечет за собой и увеличение энергии диссоциации молекулы H2 и более короткому межъядерному расстоянию по сравнению с аналогичной величиной у иона водорода. Электронное строение H2 можно записать так: sсв1 s 2.

Двухатомная молекула He2 существовать не будет, так как имеющиеся у двух атомов гелия четыре электрона расположатся на связывающей и разрыхляющей орбиталях, что приводит к нулевой кратности связи. Но в то же время ион  будет устойчив и кратность связи в нем равна 0,5. Так же, как и ион водорода, этот ион будет обладать парамагнитными свойствами
будет устойчив и кратность связи в нем равна 0,5. Так же, как и ион водорода, этот ион будет обладать парамагнитными свойствами
У элементов второго периода появляются еще четыре атомных орбитали: 2 s, 2 p x, 2 p y, 2 p z, которые будут принимать участие в образовании молекулярных орбиталей. Различие в энергиях 2 s - и 2 p -орбиталей велико, и они не будут взаимодействовать между собой с образованием молекулярных орбиталей. Эта разница в энергиях при переходе от первого элемента к последнему будет увеличиваться. В связи с этим обстоятельством электронное строение двухатомных гомоядерных молекул элементов второго периода будет описываться двумя энергетическими диаграммами, отличающимися порядком расположения на них dсв2 p x и pсв2 p y,z. При относительной энергетической близости 2 s - и 2 p -орбиталей, наблюдаемой в начале периода, включая атом азота, электроны, находящиеся на sразр2 s - и sсв2 p x-орбиталях, взаимно отталкиваются. Поэтому pсв2 p y- и pсв2 p z-орбитали оказываются энергетически более выгодными, чем sсв2 p x-орбиталь. На рис.20 представлены обе диаграммы. Так как участие 1 s -электронов в образовании химической связи незначительно, их можно не учитывать при электронном описании строения молекул, образованных элементами второго периода.
Представленные на рис. 20 энергетические диаграммы, подтвержденные спектроскопическими данными, показывают следующий порядок размещения молекулярных орбиталей с увеличением энергии от Li2 до N2 включительно:
sсв1 s < sразр1 s << sсв2 s < sразр2 s <
< pсв2 p y = pсв2 p z< sсв2 p x < pразр2 p y < pразр2 p z <<sразр2 p x,
а от O2 и далее:
sсв1 s < sразр1 s < sсв2 s < sразр2 s << sсв2 p x <
< pсв2 p y = pсв2 p z < pразр2 p y < pразр2 p z < sразр2 p x.
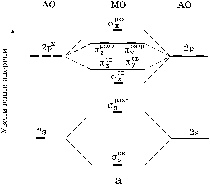
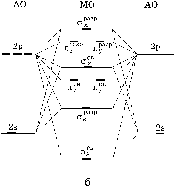
Рис. 20. Энергетические диаграммы уровней двухатомных молекул
при значительном и незначительном
энергетическом различии атомных 2s- и 2p-орбиталей
Второй период системы открывают литий и бериллий, у которых внешний энергетический уровень содержит лишь s -электроны. Для этих элементов схема молекулярных орбиталей ничем не будет отличаться от энергетических диаграмм молекул и ионов водорода и гелия, с той лишь разницей, что у последних она построена из 1 s -электронов, а у Li2 и Be2 – из 2 s -электронов. 1 s -электроны лития и бериллия можно рассматривать как несвязывающие, т. е. принадлежащие отдельным атомам. Здесь будут наблюдаться те же закономерности в изменении порядка связи, энергии диссоциации и магнитных свойств. Ион  имеет один неспаренный электрон, расположенный на sсв2 s -орбитали – ион парамагнитен. Появление второго электрона на этой орбитали приведет к увеличению энергии диссоциации молекулы Li2 и возрастанию кратности связи с 0,5 до 1. Магнитные свойства приобретут диамагнитный характер. Третий s -электрон расположится на sразр-орбитали, что будет способствовать уменьшению кратности связи до 0,5 и, как следствие этого, понижению энергии диссоциации. Такое электронное строение имеет парамагнитный ион
имеет один неспаренный электрон, расположенный на sсв2 s -орбитали – ион парамагнитен. Появление второго электрона на этой орбитали приведет к увеличению энергии диссоциации молекулы Li2 и возрастанию кратности связи с 0,5 до 1. Магнитные свойства приобретут диамагнитный характер. Третий s -электрон расположится на sразр-орбитали, что будет способствовать уменьшению кратности связи до 0,5 и, как следствие этого, понижению энергии диссоциации. Такое электронное строение имеет парамагнитный ион  . Молекула Be2, так же как и He2, существовать не может из-за нулевого порядка связи. У этих молекул число связывающих электронов равно числу разрыхляющих.
. Молекула Be2, так же как и He2, существовать не может из-за нулевого порядка связи. У этих молекул число связывающих электронов равно числу разрыхляющих.
Дальнейшее заполнение молекулярных энергетических уровней для двухатомных гомоядерных молекул и некоторых ионов элементов второго периода показано на рис. 21.
Как видно из рисунка, по мере заполнения связывающих орбиталей энергия диссоциации молекул увеличивается, а с появлением электронов на разрыхляющих орбиталях уменьшается. Ряд заканчивается нестабильной молекулой Ne2. Из рисунка также видно, что удаление электрона с разрыхляющей орбитали приводит к повышению кратности связи и, как следствие этого, увеличению энергии диссоциации и уменьшению межъядерного расстояния. Ионизация молекулы, сопровождаемая удалением связывающего электрона дает прямо противоположный эффект. Сравните энергетические диаграммы следующих двух пар молекул и ионов:  , O2,
, O2,  , N2, приведенные на рис. 21:
, N2, приведенные на рис. 21:

Рис. 21. Энергетические диаграммы двухатомных молекул и ионов
элементов второго периода Периодической системы
Гетероядерные молекулы. Из двухатомных молекул самой прочной является молекула азота, кратность связи в которой равна трем. Логично предположить, что у гетероядерных молекул и однозарядных ионов, имеющих одинаковое число электронов с N2 – четырнадцать, – кратность связи будет такой же. Такими молекулами являются CO, BF, BeNe и ионы CN–, NO+, CF+, BO–. По аналогии с молекулой азота они должны обладать высокими значениями энергий диссоциации. Такой вывод нетрудно сделать, распространяя схему молекулярных орбиталей гомоядерных молекул на гетероядерные. При этом надо учитывать, что 2- и p -орбитали с увеличением заряда ядра понижают свою энергию, а расщепление между ними по энергии растет.
Вследствие этого появляются существенные отличия в образовании молекулярных орбиталей у некоторых гетероядерных молекул от гомоядерных. Проиллюстрируем это утверждение на примере иона NO+ и молекулы CO.
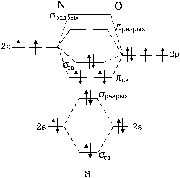

Рис. 22. Энергетические диаграммы для иона NO+ (a) и молекулы СО (б).
Поскольку заряды ядер атомов азота и кислорода отличаются на единицу, существенного отличия в энергиях их атомных орбиталей не наблюдается и схема молекулярных орбиталей иона NO+ будет аналогична схеме молекулярных орбиталей молекулы азота (см. рис. 22а). Все орбитали атома кислорода по энергии расположены ниже, чем соответствующие атомные орбитали атома углерода, т. к. заряд ядра кислорода на две единицы больше. Результатом этих энергетических различий будет существенное отличие молекулярных орбиталей оксида углерода от молекулярных орбиталей иона NO+ (см. рис. 22б). 2 s -орбиталь кислорода располагается значительно ниже 2 s -орбитали углерода, следствием чего является их слабое взаимодействие, приводящее к образованию слабосвязывающей s-орбитали, энергия которой практически не отличается от атомной 2 s -орбитали кислорода. В то же время энергии 2 p -орбиталей кислорода и 2 s -орбитали углерода близки. Эта близость приводит к образованию двух s-связывающий и s-разрыхляющей орбиталей. Если верхняя занятая s-орбиталь в ионе NO+ обладает ярко выраженным связывающим характером, то в молекуле CO эта орбиталь является слаборазрыхляющей. Поэтому ион СО+ имеет энергию диссоциации несколько большую, чем молекула СО. Образование других перечисленных выше молекул и ионов сомнительно, т. к. в них энергетические различия еще больше, чем у СО.
Металлическая связь. В отличие от ионных и ковалентных соединений металлы отличаются высокой электропроводностью и теплопроводностью. Высокая электропроводность металлов указывает на то, что электроны свободно могут передвигаться во всем его объеме. Иными словами металл можно рассматривать как кристалл, в узлах решетки которого расположены ионы, связанные электронами, находящимися в общем пользовании, т. е. в металлах имеет место сильно нелокализованная химическая связь. Совокупность электронов, обеспечивающих эту связь, называют электронным газом.
Более общий подход к представлению о ионных, ковалентных и металлических кристаллов можно получить, применяя представление метода молекулярных орбиталей к ним. Предположим, что твердое тело представляет из себя единую молекулу, образованную большим числом атомов. Внешние орбитали этих атомов при взаимодействии образуют связывающие и несвязывающие молекулярные орбитали. Энергетическая зоны, образованные связывающими молекулярными орбиталями, называют валентной зоной. Зона, объединяющая несвязывающие орбитали, называется зоной проводимости. Энергетические различия электронов в пределах зоны малы, и изменение их энергии в зоне можно представить как непрерывную полосу энергии. Между зоной проводимости и валентной зоной отсутствуют какие-либо уровни энергий. Поэтому там электроны находиться не могут. Энергетическая зона, разделяющая валентную зону и зону проводимости, носит название запрещенной.
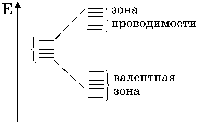
Рис. 23. Энергетические зоны в кристалле, образованные атомными орбиталями.
Электропроводность в твердом теле обеспечивается преодолением электронами запрещенной зоны, т. е. протекание электрического тока обеспечивается переходом электронов из валентной зоны в зону проводимости. В зависимости от ширины запрещенной зоны все твердые тела можно разделить на три класса: диэлектрики, полупроводники и проводники-металлы. Для изоляторов ширина запрещенной зоны составляет более 3 электронвольт, для полупроводников она лежит в пределах от 0,1 до 3 эВ. В металлах вследствие перекрывания валентной зоны и зоны проводимости запрещенная зона практически отсутствует.
Таблица 3.1
| Число электронных пар | Координация |
| Линейная | |
| Правильный треугольник | |
| Тетраэдр | |
| Тригональная бипирамида | |
| Октаэдр |
Таблица 3.2
| Число электронных пар | Координация | n | m | Тип молекул | Форма молекул | Примеры |
| Линейная | AX2 | Линейная | BeH2, BeCl2 | |||
| Тетраэдр | AX4 | Тетраэдр | CH4, SiCl4 | |||
| AX3E | Тригональная пирамида | NH3, PCl3 | ||||
| AX2E2 | Угловая | H2O, SCl2 | ||||
| Тригональная бипирамида | AX5 | Тригональная бипирамида | PCl5, AsF5 | |||
| AX4E | Дисфеноид | SF4 | ||||
| AX3E2 | Т-образная | ClF3 | ||||
| AX2E3 | Линейная | XeF2 | ||||
| Октаэдр | AX6 | Октаэдр | SF6 | |||
| AX5E | Квадратная пирамида | BrF5 | ||||
| AX4E2 | Плоский квадрат | XeF4 |
Оглавление
Глава I. Основные понятия и определения........................................ 3
1.1. Строение вещества.................................................................................... 3
1.2. Количественные соотношения в химии.................................................... 9
1.3. Химические символы и формулы............................................................. 13
Глава II. Строение атома................................................................. 19
2.1. Ранние модели атома............................................................................... 19
2.2. Квантовомеханическая модель строения атома................................. 25
Глава III. Химическая связь............................................................ 40
3.1. Заголовок................................................................................................... 40
3.2. Метод валентных связей......................................................................... 46
3.3. Метод молекулярных орбиталей............................................................ 52
[1] Левкипп (Leqkippoz) – древнегреч. философ. О жизни Левкиппа практически ничего не известно.
[2] а. е. м. – атомная единица массы, см. ниже.
[3] Электрон был первой из открытых элементарных частиц. В 1874 г. Дж. Дж. Стоней предположил, что электрический ток представляет собой поток отрицательно заряженных частиц, названных им электронами. Однако приоритет открытия электрона почти повсеместно признается за Дж. Дж. Томсоном, который экспериментально доказал наличие электрона и определил отношение его заряда к массе.
[4] Впоследствии были открыты и другие типы радиоактивного распада: b+-распад (испускание позитронов), электронный захват (захват ядром орбитального электрона), испускание запаздывающих нейтронов, спонтанное деление ядер, а в 1961 г. под руководством академика Флерова – протонный распад.
[5] Одной из основных теорем электростатики является теорема, сформулированная в XIX веке английским физиком и математиком С. Ирншоу: всякая равновесная конфигурация покоящихся точечных электрических зарядов неустойчива, если на них, кроме кулоновских сил притяжения и отталкивания, никакие другие силы не действуют. Эта теорема вытекает из утверждения, что потенциальная энергия статической системы электрических зарядов не может иметь минимума. Наличие же минимума потенциальной энергии является необходимым условием устойчивого равновесия.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4978; Нарушение авторских прав?; Мы поможем в написании вашей работы!