
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вероятностный смысл энтропии
|
|
|
|
В изолированной системе, как уже говорилось, энтропия возрастает, если происходящие в системе процессы являются необратимыми. С позиции статистической физики, процесс является обратимым, если вероятности осуществления прямого и обратного процессов соизмеримы. Если же обратный процесс маловероятен, то прямой процесс является необратимым. Примером такого процесса является расширение газа в пустоту (самопроизвольное сжатие газа маловероятно).
Энтропия связана с так называемой термодинамический вероятностью.
Термодинамической вероятностью системы 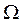 называется число различных микросостояний системы, реализующих данное макросостояние.
называется число различных микросостояний системы, реализующих данное макросостояние.
Пример: № молекулы в сосуде
Вероятность процесса будет тем выше, чем больше в результате его существования возрастёт вероятность состояния системы 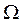 (термодинамическая вероятность).
(термодинамическая вероятность).
Число микросостояний, которое соответствует некоторому молярному объёму газа 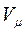 , может быть определено как Ni, тогда термодинамическая вероятность первого состояния определяется выражением
, может быть определено как Ni, тогда термодинамическая вероятность первого состояния определяется выражением
 (5.6.1)
(5.6.1)
где  – число микросостояний,
– число микросостояний, 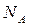 – число Авогадро (т.е. число атомов находящихся в этих состояниях).
– число Авогадро (т.е. число атомов находящихся в этих состояниях).
Воспользуемся формулой Стирлинга

(5.6.2)
И соответственно 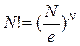
получим соотношение термодинамических вероятностей для двух различных объёмов газа  и
и  (NA! Сократится, и будем будем считать газ не очень сжатым (т.е.
(NA! Сократится, и будем будем считать газ не очень сжатым (т.е. 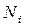 »
» 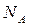 ))), тогда:
))), тогда:
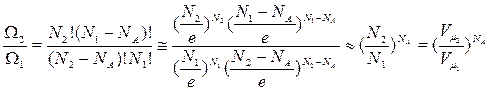
(5.6.3)
С другой стороны, в соответствии с первым началом термодинамики, разделим соотношение 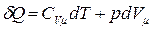 на T и получим
на T и получим
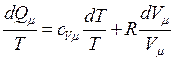
(5.6.4)
(5.6.5)
Для обратимого изотермического процесса 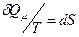 , и все изменения состояния обусловлены изменением объёма. Тогда
, и все изменения состояния обусловлены изменением объёма. Тогда  и
и 
Но 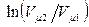 может быть рассчитан, исходя из статистических соображений. Логарифмируя соотношение (5.6.3), связывающее
может быть рассчитан, исходя из статистических соображений. Логарифмируя соотношение (5.6.3), связывающее  и
и 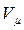 , получим
, получим
 , или
, или 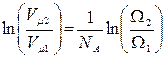
Отсюда
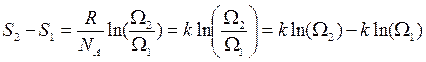
(5.6.6)
Таким образом, энтропию можно определить (с точностью до константы) в виде
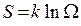 . (5.6.7)
. (5.6.7)
Это - формула Больцмана. Она связывает энтропию с термодинамической вероятностью системы. Чем выше вероятность состояния системы, тем больше энтропия системы. Т.к. в изолированной системе  , т.е. S возрастает (по крайней мере, не уменьшается), то это означает, что термодинамическая вероятность в такой системе тоже растёт.
, т.е. S возрастает (по крайней мере, не уменьшается), то это означает, что термодинамическая вероятность в такой системе тоже растёт.
Все процессы в изолированной системе протекают в сторону увеличения вероятности состояния системы.
Это статистическое толкование второго начала термодинамики.
Из статистики следует что, в относительно малых системах возможны флуктуации, которые могут приводить к кратковременному уменьшению энтропии. Таким образом, 2-е начало не содержит в себе абсолютного запрета убывания энтропии. Другое дело, что на практике для систем с очень большим числом частиц закон неубывания энтропии выполняется без исключений.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2809; Нарушение авторских прав?; Мы поможем в написании вашей работы!