
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние рН и концентрации реагентов на коэффициент распределения
|
|
|
|
Экстракцию можно рассматривать как гетерогенную реакцию. Например, при экстракции внутрикомплексных соединений MLm равновесие представлено уравнением:

Константа этого равновесия константой экстракции:
 (2)
(2)
Коэффициент распределения:
 (3)
(3)
При условии, что в водной фазе можно пренебречь всеми формами металла, кроме иона  , а в органической фазе – единственной формой металла является комплекс
, а в органической фазе – единственной формой металла является комплекс  , тогда коэффициент распределения запишем:
, тогда коэффициент распределения запишем:
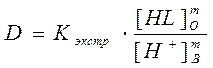 (4)
(4)
После логарифмирования:
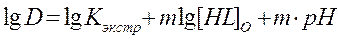 (5)
(5)
При постоянном рН, зависимость  от
от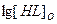 выбирается прямой линией с углом наклона = m, при постоянной концентрации реагентаHL, аналогичная зависимость от рН.
выбирается прямой линией с углом наклона = m, при постоянной концентрации реагентаHL, аналогичная зависимость от рН.
Этот прием называется методом сдвига равновесия или билогарифмический метод. Широко используется для определения состава экстрагирующих соединений в различных экстрационных системах.
Экспериментально изучают зависимость коэффициента распределения от рН и концентрации реагента при постоянных концентрациях всех других компонентов.
Исследуя графические зависимости в билогарифмических координатах, находят тангенсы углов наклона соответствующих прямых, равные стехиометрическим коэффициентам в уравнениях экстракции. Равновесную концентрацию реагента обычно приравнивают к исходной, так как для количественного извлечения металла используют большой избыток реагента.
Пример 2: Ионы Cu(II) экстрагируются из водного раствора, насыщенного диметилглиоксидом (H2L), раствором хинолина (В) в хлороформе в виде комплекса Cu(HL)2В.Напишите уравнение реакции и выражение для константы экстракции. Изобразите зависимость 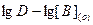 при постоянном рН и постоянной концентрации H2L. Какую информацию и как можно получить из этой зависимости?
при постоянном рН и постоянной концентрации H2L. Какую информацию и как можно получить из этой зависимости?
Решение: Согласно условию задачи ионы меди и диметилглиоксим находятся в водной фазе, а хинолин и комплекс Cu(HL)2В в органической. Т.о., экстракционное равновесие в этой системе может быть описано следующим уравнением:

Тогда

После логарифмирования получим:

или

Припостоянной концентрации диметилглиоксима и постоянном рН имеем линейную зависимость логарифма коэффициента распределения от логарифма равновесной концентрации хинолина с тангенсом угла наклона, равным единице (рис.1).
Таким образом, из графической зависимости 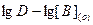 при постоянной концентрации H2L и постоянном рН можно определить число молекул хинолина, входящих в состав экстрагирующегося комплекса. Кроме того, эта зависимость позволяет графически определить константу экстракции, поскольку отрезок а, отсекаемый прямой от оси ординат, есть ни что иное, как
при постоянной концентрации H2L и постоянном рН можно определить число молекул хинолина, входящих в состав экстрагирующегося комплекса. Кроме того, эта зависимость позволяет графически определить константу экстракции, поскольку отрезок а, отсекаемый прямой от оси ординат, есть ни что иное, как  .
.
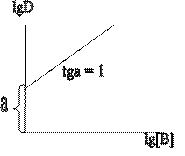
Пример 3: Используя данные примера 1, рассчитайте константу экстракции для цинка и свинца.
Решение: Экстракция ионов цинка и свинца раствором 8-оксихинолина в хлороформе описывается уравнением:

Тогда

Поскольку исходная концентрация металлов намного меньше исходной концентрации 8-оксихинолина, равновесную концентрацию реагента можно приравнять к исходной. Тогда, с учетом коэффициентов распределения, рассчитанных в примере 1, получим:
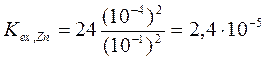
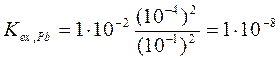
Пример 4: Ион металла экстрагируются на 33% в виде ML2 из 100 мл
экстрагируются на 33% в виде ML2 из 100 мл 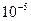 М раствора при рН 5 с помощью хелатообразующего реагента HL в органическом растворителе. Рассчитайте степень извлечения иона металла: а) из 100мл
М раствора при рН 5 с помощью хелатообразующего реагента HL в органическом растворителе. Рассчитайте степень извлечения иона металла: а) из 100мл 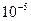 М раствора при рН 6 с помощью 20 мл
М раствора при рН 6 с помощью 20 мл 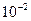 М раствора хелатообразующего реагента HL в органическом растворителе; б) из 100мл
М раствора хелатообразующего реагента HL в органическом растворителе; б) из 100мл 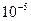 М раствора при рН 6 с помощью 50 мл
М раствора при рН 6 с помощью 50 мл  М раствора хелатообразующего реагента HL в органическом растворителе.
М раствора хелатообразующего реагента HL в органическом растворителе.
Решение: а) Экстракция иона металла в форме хелата ML2 с хелатообразующим реагентом HL описывается уравнением:
в форме хелата ML2 с хелатообразующим реагентом HL описывается уравнением:

Тогда

Выразим коэффициент распределения D из формулы для расчета степени извлечения и подставим в выражение для Кех. Тогда:
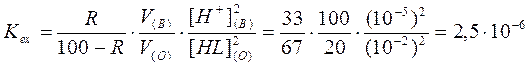
И в этом примере равновесная концентрация реагента приравнена к исходной, поскольку  . Изменение рН, концентрации реагента и соотношения объемов водной и органической фаз оказывает влияние на степень извлечения, но не на величину Кех, поэтому:
. Изменение рН, концентрации реагента и соотношения объемов водной и органической фаз оказывает влияние на степень извлечения, но не на величину Кех, поэтому:

Тогда


Расчет показывает, что увеличение рН раствора на единицу позволяет увеличить степень извлечения иона металла от 33% до 98%.
б) По условию необходимо провести расчет степени извлечения при изменившихся значениях рН, концентрации и соотношения объемов фаз. Поэтому:

тогда


Расчет показывает, что увеличение соотношения объемов фаз позволяет достичь практически такой же степени извлечения иона металла, как и предыдущем примере, но при меньшей концентрации хелатообразующего реагента.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2837; Нарушение авторских прав?; Мы поможем в написании вашей работы!