
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический состав воды
|
|
|
|
В природе невозможно найти химически чистую воду. Благодаря ее высокой растворяющей способности и подвижности происходит перераспределение (миграция) химических элементов в земной коре.
В природных водах присутствуют практически все элементы системы Менделеева в виде ионов, недиссоциированных молекул (и газов), и коллоидов. Однако концентрации их резко различны. В зависимости от содержания в воде элементы делятся на 2 группы: макрокомпоненты и микрокомпоненты.
14.5.1. Макрокомпоненты
Макрокомпонентысодержатся в концентрациях 1 мг/л и выше. Сюда относятся Na, Ca, Mg и Сl, присутствующие в виде простых ионов, а также углерод, сера, азот, кислород, водород и кремний, присутствующие в виде сложных ионов (НСО3, SO4 и т.д.), недиссоциированных молекул и коллоидов (Н2SiО3) и растворенных газов. Кроме того содержится большой комплекс органических веществ (органические кислоты, фенолы, ароматические углеводороды, гуминовые и фульфокислоты).
С некоторой условностью к макрокомпонентам можно отнести также нитрат-ион (NО3), который хотя и очень редко, встречается в преобладающих относительно других анионов количествах, особенно в поверхностных и грунтовых водах. То же относится и к органическим веществам, например органическим кислотам, концентрации которых могут составлять десятки и сотни мг/л.
14.5.2. Классификация вод по величине минерализации.
Среди первых классификаций следует назвать классификацию В.И. Вернадского.
В современном виде классификация выглядит следующим образом
(табл. 5).
Таблица 5.
Классификация вод по величине минерализации.
| Класс вод | Подкласс вод | Минерализация, г/л |
| Пресные | Ультрапресные | <0,1 |
| Умеренно пресные | 0,1-0,5 | |
| Собственно пресные | 0,5-1,0 | |
| Солоноватые* | Слабосолоноватые | 1-3 |
| Умеренно солоноватые | 3-10 | |
| Соленые | 10-35 | |
| Рассолы | Слабые | 35-100 |
| Крепкие | 100-320 | |
| Сверхкрепкие | 320-500 | |
| Предельно насыщенные | > 500 |
*По ГОСТ 14403-72 к солоноватым отнесены воды с общей минерализацией 1-25 г/кг, что, по сути, неверно. Разделяю в этом вопросе точку зрения С.Л. Шварцева.
14.5.3. Микрокомпоненты
Содержание их в воде как правило составляет доли мг/л (мкг/л). Однако отдельные микрокомпоненты могут встречаться в природных водах и в довольно значительных количествах - до г/л, например Вr, В, J в рассолах, Zn, Cu, Mn в рудничных и шахтных водах.
Формы соединений в водах многих микрокомпонентов разнообразны (комплексные ионы, металл-органические соединения, коллоиды, взвеси).
Они еще сравнительно слабо изучены, поэтому при интерпретации анализов большинство из них выражают в виде соответствующих индексов элементов (Cu, Mo, As, Pb и т.д.), полученных при спектральном анализе. Более точные данные получают при химическом анализе микрокомпонентов.
Основные физические свойства воды обусловливаются содержанием в воде макрокомпонентов, представляющих так называемый ионно-солевой состав воды, общую минерализацию и сухой остаток.
Большую роль в определении свойств природных вод играют показатели, характеризующие состояние воды и в значительной мере определяющие присутствие в воде элементов в тех или иных соединениях. К числу таких показателей относятся рН и Еh вод.
14.5.4. Ионное произведение и активная реакция воды. рН.
Как известно, вода диссоциирует по уравнению:
Н2О↔Н+ + ОН-
Однако степень диссоциации воды очень мала. При температуре = 220С из 55,51 г/молей воды, содержащихся в 1л (1000:18,016 = 55,51) только 10-7г/моль находятся в виде ионов. На основании закона действующих масс константа диссоциации воды (при температуре 220С)
К Н2О = [H+][ ОH] = 10-7·10-7/55,51
[ H2О]
Поскольку 55,51>>10-7, изменение степени ионизации воды даже в сотни тысяч раз практически не изменит величины [ H2О], что позволяет считать ее постоянной (константа диссоциации воды-Кв).
Тогда, Кв = [H+][ ОH] = 10-7·10-7 = 10-14
Это постоянное (для данной температуры) произведение называется ионным произведением воды. Концентрацию ионов водорода и гидроксила выражают в виде отрицательного логарифма - рН и рОН. рН = -lg [H+] рОН = -lg [ОH-]
- lgН = рН = 7. В чистой воде имеется равенство ионов Н+ и ОH- и вода является нейтральной. Но вода, содержащая растворенные вещества, имеет кислую или щелочную реакцию. При кислой реакции [H+] > [ОH-], а при щелочной - [H+] < [ОH-].
рН+рОН = -lg10-14 = 14. Значит, при нейтральной реакции при t = 220С
рН = рОН = 14/2= 7
рН >7 – щелочная рОН < 7
рН < 7 –кислая рОН > 7
При температуре кипения (1000С) [H+][ ОH] = 10-6·10-6 = 10-12
Нейтральная вода при рН = 6
При надкритической температуре (4000С) - нейтральная вода при рН=4,5.
14.5.5. Окислительно-восстановительный потенциал воды
Окислительно-восстановительные реакции, связаны с потерей или присоединением электронов:
Fe2+ ↔ Fe3++e или Fe2+ - e = Fe3+
Окислительно-восстановительная способность системы определяется окислительно-восстановительным потенциалом (ОВП), который замеряется при сравнении с индифферентным (золотым или платиновым) электродом и выражается следующим уравнением:


где, Еh – потенциал индифферентного электрода, отнесенный к нормальному водородному полуэлементу, Е0 – нормальный потенциал системы – постоянная, характеризующая данную ОКВ – систему, значение которой замеряется при концентрациях окисленной и восстановленной части системы, соответствующей 1 молю каждая: R – газовая постоянная – 8,313 дж/град, Т – абсолютная температура, n – число электронов, участвующих в реакции, F – заряд грамм – иона, равный 96500 к, [Ox] и [red] – молярные концентрации окисленной и восстановленной формы или

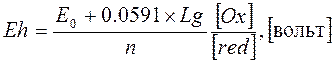
Определяют ОКВ – потенциал электрометрическим измерением с помощью компенсационной схемы разности потенциалов электрохимической ячейки: платиновый электрод, погруженный в исследуемую воду, каломельный электрод. Последний электрод имеет постоянный потенциал, зависящий только от температуры. Обычно применяют чувствительный приборы – потенциометры с ламповыми усилителями, выпускаемыми нашей промышленностью. Для полевых условий – рН – метры ППМ-01-М. Потенциал – задающими в водах обычно являются элементы с переменной валентностью при концентрации не менее 1·10-5 моль/л. Это Fe,Mn,H2S, органически вещества и др.
14.5.6 Типы химического анализа при гидрогеологических исследованиях
Химический анализ природных вод проводится при решении следующих задач:
1) изучение закономерностей формирования и распространения природных вод различного состава; 2) поиски месторождений полезных ископаемых (нефти и газа, металлов, солей и др.) гидрогеохимическим методом; 3) оценка природных вод как химического сырья для получения J, Br, B, Cu, Ba и др.; 4) поиски месторождений минеральных вод; 5) оценка качества воды для питьевого, технического, сельскохозяйственного и других видов использования; 6) оценка условий загрязнения.
Для общей характеристики ионно-солевого состава природных вод применяют три типа анализа воды – полевой, сокращенный и полный.
Полевой анализ производится в полевых условиях с помощью походных лабораторий различных конструкций. Определение обычно делается массово для предварительной оценки состава природных вод изучаемого района. При полевом анализе проводится определение физических свойств Сl, SO4, NO3, HCO3, CO3, Ca, Mg, Fe+2, Fe+3, СО2, Н2S, О2.
Вычисляются Na+K, Mg или Ca, карбонатная жесткость, общая минерализация.
Сокращенный анализ проводится более точными методами в стационарной или полустационарной лаборатории. Он позволяет произвести контроль анализа. В комплексе сокращенного анализа в дополнение к перечисленному для полевого входит определение NH4,NO2, H2SiO3, агрессивная СО2, жесткость общая.
Полный анализ производится наиболее точными методами в стационарной лаборатории. Кроме компонентов, перечисленных в комплексе сокращенного анализа он предусматривает раздельное определение Na и K, окисляемость воды, а при изучении артезианских вод - J, Br, B.
При проведении специальных исследований проводится определение состава спонтанных и растворенных газов: Н2S, СО2, О2, СН4, N2++ редк., Аr + Кr + Хe, Нe, + Ne и тяжелые углеводороды.
При постановке гидрогеохимических исследований необходимо определять большой комплекс микрокомпонентов: Li, Rb, Cr, Ba, As, Sb, Pb, Zn, Cd, Ni, Co, U, R, органические вещества и др.
Для их определения разработаны и разрабатываются различные методы: экстрационно-колориметрический, спектральный, полярографический, флуориметрический, пламенно-фотометрический и др.
Очень низкое содержание многих микрокомпонентов в водах заставляет применять предварительное концентрирование веществ, т.е. получать водные концентраты, а затем уже определять в них соответствующие элементы.
В настоящее время широко применяются три метода концентрирования:
1) Выпаривание до сухого остатка. Метод трудоемок и ограничен водами с минерализацией 1-2 г/л; 2) метод соосаждения с гидратом гидроокиси алюминия (метод ТПИ). Он позволяет концентрировать микрокомпоненты почти в 20000 раз и определять свыше 20 химических элементов.
Второй метод наиболее широко применяется в Сибири и на Дальнем Востоке; 3) метод осаждения с сульфидом кадмия (Витр-ЛТИ). Степень концентрации здесь меньше и составляет 3000-4000.
Методы перечисленные выше относятся к групповому концентрированию. Существуют и методы индивидуального концентрирования отдельных компонентов (элюация на угле, адсорбция на ионно-обменных смолах и др.).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2048; Нарушение авторских прав?; Мы поможем в написании вашей работы!