
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимические расчеты. Закон Гесса
|
|
|
|
Стандартное состояние
В химической термодинамике стандартным состоянием называется состояние системы, выбираемое как точка отсчета при оценке термодинамических величин. Необходимость выбора стандартного состояния обусловлена тем, что в рамках химической термодинамики не могут быть рассчитаны абсолютные значения энергий Гиббса, энтальпий и других термодинамических функций для данного вещества. Возможен лишь расчет относительных значений этих величин в данном состоянии по сравнению с их значением в стандартном состоянии. Значения термодинамических величин в стандартном состоянии называют стандартными и обозначают нулем в верхнем индексе, например D H °, D G °, S °.
Стандартное состояние характеризуется стандартными условиями. Комиссия по термодинамике Международного союза теоретической и прикладной химии (ИЮПАК) в 1975 году определила в качестве основного стандартного состояния:
- для газообразных веществ - чистое вещество в состоянии идеального газа с давлением p °=1 атм (1.01×105Па) при температуре Т °=298.15 К;
- для твердых веществ - чистое вещество, находящееся под внешним давлением p °=1 атм (1.01×105Па) при температуре Т °=298.15 К.
В качестве стандартного состояния для простых веществ принимают устойчивое фазовое и химическое состояние элемента при данной температуре. Например, для углерода, способного существовать в нескольких аллотропных модификациях, стандартным состоянием будет являться углерод в форме графита. Исключением из данного правила являются фосфор и олово, для которых в справочниках приводятся данные по наиболее доступным модификациям, т.е. по белому фосфору и белому олову.
Для расчета теплового эффекта химических реакций используют термохимические уравнения, в которых обязательно указывается агрегатное состояние реагирующих веществ и продуктов реакции: (Г) - газ, (Ж) - жидкость, (ТВ) - твердое (кристаллическое) вещество. Для твердых веществ указывается их полиморфная модификация: С(ГРАФИТ), С(АЛМАЗ) и т.д. Для веществ, участвующих в реакциях в водных растворах, указывается индекс (aq). В термохимических уравнениях также обязательно указывается тепловой эффект (Q) или изменение энтальпии химической реакции (D H °Х.Р.), рассчитанные для стандартных условий (D H °Х.Р.), например:
C(ГРАФИТ) + O2 (Г) = CO2 (Г) + 393.5 кДж или
C(ГРАФИТ) + O2 (Г) = CO2 (Г) D H °Х.Р.= -393.5 кДж.
При использовании разных форм записи термохимических уравнений следует учесть, что Q = -D H Х.Р..
Первым важнейшим законом термохимии явился закон Лавуазье-Лапласа (1783г.), согласно которому: тепловые эффекты химических реакций, протекающих в прямом и обратном направлении равны по величине и противоположны по знаку, например:
H2 (Г) + I2 (ТВ) = 2HI(Г) D H °Х.Р.= +51.8 кДж
2HI(Г) = H2 (Г) + I2 (ТВ) D H °Х.Р.= -51.8 кДж
Однако основу всех термохимических расчетов составляет закон Гесса (1840г.): тепловой эффект химической реакции, протекающей либо при постоянном давлении, либо при постоянном объеме, зависит только от состояния исходных и конечных веществ (продуктов реакции) и не зависит от пути протекания, т.е. числа и последовательности промежуточных стадий, причем температура исходных и конечных веществ должна быть одинакова.
Рассмотрим реакцию получения оксида фосфора (V) окислением красного фосфора:
2P(КРАСН) + 5/2O2 (Г) = P2O5 (ТВ) D H °Х.Р.1= -1492 кДж
Оксид фосфора (V) может быть получен и другим способом. Первоначально фосфор окисляется в оксид фосфора (III):
2P(КРАСН) + 3/2O2 (Г) = P2O3 (ТВ) D H °Х.Р.2= -820 кДж
Образовавшийся P2O3 при дальнейшем окислении превращается в P2O5:
P2O3 (ТВ) + O2 (Г) = P2O5 (ТВ) D H °Х.Р.3= -672 кДж
Суммируем эти две стадии и их тепловые эффекты:
2P(КРАСН) + 3/2O2 (Г) + P2O3 (ТВ) + O2 (Г) = P2O3 (ТВ) + P2O5 (ТВ)
__________________________________________________
2P(КРАСН) + 5/2O2 (Г) = P2O5 (ТВ)
D H °Х.Р.2 + D H °Х.Р.3 = -1492 кДж
Таким образом тепловые эффекты реакций образования P2O5 как непосредственно из фосфора и кислорода, так и через промежуточную стадию образования и окисления P2O3 равны:
D H °Х.Р.1= D H °Х.Р.2 + D H °Х.Р.3,
что полностью соответствует закону Гесса. Данные рассуждения могут быть представлены графически в виде энтальпийной диаграммы (рис. 1.1).
D H, кДж
2P(КРАСН) + 5/2O2 (Г)



 0
0
D H 2
 -500
-500
D H 1 P2O3 (ТВ) + O2 (Г)
 |
 -1000
-1000
D H 3
P2O5 (ТВ)

 -1500
-1500
Рис. 1.1. Энтальпийная диаграмма процесса окисления фосфора.
Закон Гесса, отражающий свойство энтальпии, как функции состояния, позволяет комбинировать термохимические уравнения между собой с целью получения необходимой реакции. Для упрощения термохимических расчетов используется понятие энтальпии образования сложного вещества из простых веществ.
Энтальпией образования сложного вещества из простых веществ называется изменение энтальпии в реакции образования данного вещества из простых веществ в стандартных состояниях, отнесенный к одному молю получающегося вещества. Энтальпию образования обычно относят к стандартным условиям, называют стандартной энтальпией образования и обозначают D f H °298.
Так, для гидрокарбоната натрия (NaHCO3), стандартная энтальпия образования будет соответствовать тепловому эффекту реакции:
Na (ТВ) + 1/2H2 (Г) + C (ГРАФИТ) + 3/2O2 (Г) = NaHCO3 (Г)
(Следует представлять, что записанное термохимическое уравнение - условное, и соответствующая ему химическая реакция не будет идти в стандартных условиях.)
Стандартная энтальпия образования простых веществ, находящихся в наиболее устойчивой в стандартных условиях аллотропной модификации, принята равной нулю.
Значения стандартных энтальпий образования различных веществ определяются экспериментально или рассчитываются теоретически и заносятся в химические справочники, например, Справочник химика. В данном методическом указании значения D f H °298 приведены в табл. 4.1. на с. 23-24. Общепринятая размерность стандартных энтальпий образования - кДж/моль.
Закон Гесса имеет важное следствие, согласно которому, тепловой эффект химической реакции представляет собой разность между суммой стандартных энтальпий образования продуктов реакции и суммой стандартных энтальпий образования исходных веществ:
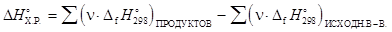 ,
,
где n - стехиометрические коэффициенты, с которыми исходные вещества и продукты реакции входят в термохимическое уравнение реакции.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2677; Нарушение авторских прав?; Мы поможем в написании вашей работы!