
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм реакции
|
|
|
|
Разные авторы по-разному определяют важнейшее в органической химии понятие механизма реакции, но если вдуматься, то за терминологическими различиями скрывается одна и та же сущность. Для облегчения понимания этой сущности здесь приводятся несколько определений механизма реакции.
По Пальму В.А.:
Механизм химической реакции характеризуется природой и путями образования промежуточных или параллельно возникающих относительно стабильных молекул (ионов и свободных радикалов). Под относительно стабильной молекулой понимают частицу со временем жизни более 10-13 с – времени жизни активированного комплекса.
Брутто-процесс реакции можно разбить на элементарные стадии так, что возникновение каждого относительно стабильного промежуточного или параллельного продукта определяет одну элементарную стадию.
Промежуточные относительно стабильные продукты в свою очередь целесообразно подразделить на стабильные, которые могут быть препаративно изолированы из реакционной смеси, и нестабильные, для которых это невозможно.
Брутто-реакция может быть разбита на макроскопические стадии, на каждой из которых происходит превращение одного стабильного промежуточного продукта в другой. Каждая макроскопическая стадия может быть в свою очередь разбита на элементарные стадии, любая из которых соответствует либо возникновению, либо исчезновению какого-либо нестабильного промежуточного продукта.
Элементарная стадия также характеризуется определенным механизмом. Здесь проблема сводится к строению активированного комплекса (переходного состояния) и способам разрыва и возникновения связей в этом комплексе.
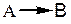 – брутто-реакция.
– брутто-реакция.
Механизм этой реакции:
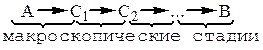
где: Сi – стабильные промежуточные продукты.
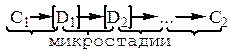
где: Di – нестабильные промежуточные продукты (интермедиаты).
Природа устроена так, что этих интермедиатов не так уж и много (радикалы, ионы, карбены, нитрены). Грань между стабильными промежуточными продуктами и нестабильными промежуточными продуктами нечеткая.
D1 → Е1≠ → D2 – элементарная стадия,
где: Е1≠ – активированный комплекс (переходное состояние).
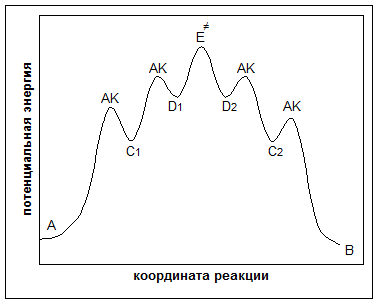
Рисунок 3. Протекание сложной реакции, состоящей из трех последовательных простых реакций (макростадий), две из которых являются элементарными реакциями (микростадиями, элементарными стадиями), а одна – неэлементарной реакцией, состоящей из двух элементарных реакций (микростадий, элементарных стадий).
Элементарная стадия может быть в действительности неэлементарной, но пока нет соответствующей экспериментальной техники, позволяющей доказать существование интермедиатов («увидеть» точную конфигурацию атомов в реагирующих молекулах), ее приходится рассматривать как элементарную (рис. 4).

Рисунок 4. Протекание реакции через множество интермедиатов.
По Бучаченко А.Л.:
Химический механизм – это представление о том, в какой последовательности и в каких комбинациях реагируют молекулы (атомы, ионы, радикалы), какие промежуточные частицы (интермедиаты) реагирующая система создает на своем пути от старта (реагенты) до финиша (продукты). По сути, такое представление может быть названо детальным или механистическим механизмом реакции. Обычно для установления механистического механизма используют совокупность подходов и методов, из которых главным является метод химической кинетики.
Определив форму кинетического уравнения, порядок, константу скорости и энергию активации реакции, химическая кинетика отвечает на вопрос, каков механистический механизм реакции: в каких комбинациях молекулы (частицы) вступают в реакцию, какие интермедиаты возникают на пути к продуктам и в какой последовательности они реагируют. При этом, измеряя константу скорости, кинетика выступает как химический бухгалтер: она считает число реагирующих молекул, то есть число актов реакции в единицу времени (другими словами, количество химических событий, происходящих за единичное время, например, за секунду); фактически она измеряет интервал времени между этими событиями, но ничего не говорит о том, как происходят элементарные акты этих событий.
Химическая реакция, т. е. преобразование молекул-реагентов в молекулы-продукты, обычно протекает через несколько элементарных актов (стадий), включающих перегруппировку атомов (частиц) и преобразование их электронных оболочек («одежд»). Собственно элементарный акт и есть элементарная химическая реакция, происходящая на так называемой поверхности потенциальной энергии реагирующей системы, когда система движется из долины регентов в долину продуктов данной элементарной стадии через перевал, высота которого по отношению к уровню долины реагентов есть энергия активации элементарной стадии, а конфигурация (взаимное расположение) атомов (частиц) реагирующей системы на вершине перевала есть переходное состояние элементарной стадии (реакции). Времена этих перемещений и атомных прегруппировок сравнимы с периодами колебаний атомов в молекулах и составляют 10-12–10-11 с (1-10 пс). Другими словами, длительность элементарного химического события составляет величину порядка нескольких пикосекунд.
В последние годы разработана техника генерации и детектирования ультракоротких лазерных импульсов с длительностью 10-15–10-14 с (1-10 фс), что гораздо короче периодов колебаний атомов в молекулах. Используя такие повторяющиеся зондирующие импульсы, можно осуществить мониторинг движения атомов реагирующей системы на пути из долины реагентов в долину продуктов, включая вершину перевала (переходное состояние) и его окрестности.
Наука, исследующая временнόе поведение реагирующей системы на перевале и в его окрестностях, называется химической динамикой. В отличие от химической кинетики, измеряющей время между химическими событиями, химическая динамика измеряет время самого (элементарного) события, следит за движением атомов (частиц) в момент преобразования реагентов в продукты. Если химическая реакция – сердце всей химии, то графическое изображение химической динамики есть кардиограмма этого сердца. Химическая динамика сообщает, как движутся атомы (частицы) на поверхности потенциальной энергии, как осуществляется перегруппировка атомов в момент рождения новых молекул из реагентов. По сути химическая динамика может быть названа химической машинерией.
В таблице представлена эволюция химической кинетики в химическую динамику.
Таблица 1
Химическая кинетика и химическая динамика: иерархия времен
| Ступень эволюции | τ, с | Техника |
| Кинетика | 105-102 102-10-2 10-2-10-4 10-4-10-8 10-8-10-11 | Отбор и контроль проб Струя Остановленная струя Молекулярные пучки Лазерные технологии (ИК и оптическая хемилюминесценция, когерентное возбуждение, лазерно-индуцированная флуоресценция, время-пролетная масс-спектрометрия, допплер-эффект, резонансно-усиленная многофотонная ионизация, когерентное комбинационное рассеяние, спектроскопия нулевой кинетической энергии) |
| Динамика | 10-12-10-15 | Современные лазеры (фемтосекундные лазерные импульсы – «фемтохимия») |
Лекция 2
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 910; Нарушение авторских прав?; Мы поможем в написании вашей работы!