
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика электрохимического коррозионного процесса
|
|
|
|
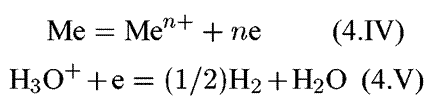 |
`В простейшем случае коррозии металлов с образованием их растворимых продуктов (т.е. ионов Меn+) коррозионные процессы принято называть процессами растворения металлов. Образование ионов металла из его атомов, например, в кислом растворе электролита можно представить совокупностью реакций в которой электроны освобождаются, и в которой электроны, освободившиеся в реакции (4.IV), присоединяются к ионам водорода. В результате на металле одновременно протекают две реакции — анодная (4.IV) и катодная (4.V).
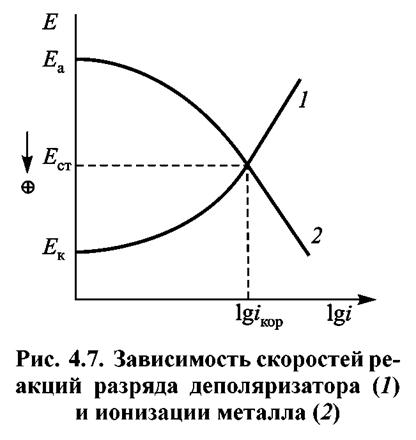 |
Перенос электронов осуществляется на поверхности металла, а перемещение ионов — в электролите. Явления, которые при этом происходят, изображены на рис. 4.7.
При протекании электрохимического процесса анодный и катодный потенциалы Еа и Ек выравниваются и принимают значение потенциала ЕСТ. Этот потенциал называют потенциалом свободной коррозии.
При ЕСТ соблюдается равенство катодного и анодного токов, т.е.
ia = iк = iкор
где iкор — скорость коррозии или саморастворения металла.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 730; Нарушение авторских прав?; Мы поможем в написании вашей работы!