
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Самопроизвольного процесса в изолированной системе
|
|
|
|
Свойства энтропии. Энтропия – критерий направления
1. Энтропия – функция состояния системы, т.е. ее изменение D S зависит только от энтропии исходного и конечного состояний системы.
2. Энтропия характеризует вероятность реализации системы. Чем больше энтропия, тем больше способов реализации системы. Например, энтропия возрастает при распаде молекул ВМС на отдельные фрагменты, при переходе вещества из твердого в жидкое и газообразное состояние при постоянной температуре, при нагревании вещества (так как усиливается тепловое движение молекул и возрастает беспорядок). Количественно эта взаимосвязь выражается формулой Больцмана
S = k ln W,
где W – термодинамическая вероятность; k – константа Больцмана, k = 1,38×10-23 Дж/К.
Термодинамическая вероятность W – это число микросостояний системы, с помощью которых реализуется данное макросостояние. Макросостояние системы характеризуется параметрами состояния (p, V, T, хим. состав). Но термодинамическая система состоит из огромного числа микрочастиц, имеющих определенную энергию, скорость, направление движения, поскольку находятся в непрерывном хаотичном движении. При равновесии макросостояние не изменяется, т.е. макросвойства (p, V, T, хим. состав) остаются постоянными, а микросвойства (положение частицы в объеме системы, энергия, скорость ее) непрерывно меняются. Наблюдаемое макросостояние осуществляется разными микросостояниями, количество которых характеризует термодинамическая вероятность. В отличие от математической вероятности, равной отношению числа благоприятных событий к общему числу возможных событий, а поэтому всегда меньшей единицы, термодинамическая вероятность может быть очень большой величиной.
3.Энтропия – критерий направления самопроизвольного процесса в изолированной системе.
 В изолированных системах отсутствует подвод теплоты из внешней среды (Q = 0), поэтому, согласно II закону термодинамики (2), в изолированной системе энтропия либо остается постоянной в состоянии равновесия, либо возрастает при необратимом (самопроизвольном) течении процесса. Рост энтропии продолжается до установления равновесного состояния, при этом значение энтропии максимально S max (рисунок).
В изолированных системах отсутствует подвод теплоты из внешней среды (Q = 0), поэтому, согласно II закону термодинамики (2), в изолированной системе энтропия либо остается постоянной в состоянии равновесия, либо возрастает при необратимом (самопроизвольном) течении процесса. Рост энтропии продолжается до установления равновесного состояния, при этом значение энтропии максимально S max (рисунок).
Расчет изменения энтропии при фазовом переходе,
нагревании (охлаждении), при протекании химической реакции
Для реальных (необратимых) процессов II закон термодинамики записывается в идее неравенства, что затрудняет расчет изменения энтропии D S при их протекании. Но энтропия – функция состояния системы, и ее изменение не зависит от пути проведения процесса. Поэтому для расчета D S при протекании различных процессов воспользуемся уравнением II закона для обратимых процессов:
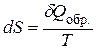 . (1)
. (1)
Изменение энтропии при фазовых превращениях
Фазовое превращение (фазовый переход) – процесс, связанный с изменением агрегатного состояния вещества.
Характерной особенностью этих процессов является то, что они протекают при постоянной температуре – температуре фазового перехода Т ф.п..
Тогда, согласно II закону термодинамики
 ,
,
где Q ф.п. – тепловой эффект фазового перехода.
При р = const теплота равна изменению энтальпии:
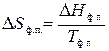
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 541; Нарушение авторских прав?; Мы поможем в написании вашей работы!