
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катализ и катализаторы
Катализ – процесс изменения скорости химической реакции путем введения в реакционную среду катализатора.
Катализатор – вещество, участвующее в ходе химической реакции и изменяющее ее скорость, но остающееся после реакции в неизменном виде.
Различают положительный катализ, (скорость реакции увеличивается), отрицательный катализ, (скорость реакции уменьшается), аутокатализ (катализатор образуется в ходе химической реакции), гомогенный катализ (катализатор находится в одинаковом агрегатном состоянии с реагирующими веществами), гетерогенный катализ (катализатор находится в другом агрегатном состоянии, чем реагирующие вещества).
Важной особенностью процесса катализа является снижение энергии активации. Катализатор, попадая в реакционную среду, образует активированный комплекс с одним из реагирующих веществ. Затем активированный комплекс вступает в реакцию с другими реагирующими веществами, образуя продукты реакции и катализатор. Действие катализатора сводится к открытию нового реакционного пути, на котором катализатор непосредственно взаимодействует хотя бы с одним из реагирующих веществ, и при этом энергия образования активированного комплекса значительно ниже.
 U ак A + B = C + D А + К = АК
U ак A + B = C + D А + К = АК
активированный комплекс АК + В = С + D + K
Еа
A+B АК+В
C+D
 ход реакции
ход реакции
Рис.: энергия активации в присутствии катализатора.
Роль катализаторов в организме отводится ферментам. Ферментный катализ имеет ряд особенностей:
1. Высокая каталитическая активность. По своей активности ферменты в миллионы раз превосходят химические катализаторы, поэтому для реакций их надо очень мало.
2. Высокая специфичность. Каждый фермент действует на строго определенную реакцию или группу реакций.
3. Ферменты проявляют свою активность при строго определенном значении рН среды.
4. Ферменты наиболее активны при температуре 370С ÷ 400С, при более низкой температуре ферменты становятся менее активны, а при более высокой – происходит денатурация ферментов.
Пример реакции: фермент + субстрат = фермент-субстратный комплекс
фермент-субстратный комплекс = продукт + фермент

 Vp Vp Vp – скорость реакции
Vp Vp Vp – скорость реакции

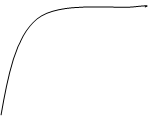 Vp max [E] – фермент (энзим)
Vp max [E] – фермент (энзим)
[S] – субстрат
 1/2Vp max 1/2Vp max = К – const Михаэлиса
1/2Vp max 1/2Vp max = К – const Михаэлиса
Vp = ([E] · [S]) / (K + [S])
 |  |
[E] [S]
Рис.: Зависимость скорости реакции от концентраций энзима и субстрата.
|
|
Дата добавления: 2014-01-07; Просмотров: 4360; Нарушение авторских прав?; Мы поможем в написании вашей работы!