
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Регулирование рН среды за счет частичного или полного разложения до аммиака
|
|
|
|
Восстановление и стабилизация защитных свойств оксидных пленок конструкционных материалов оборудования 2 контура.
Связывание коррозионно-агрессивного кислорода.
Гидразинно-аммиачный ВХР-2
ГА ВХР-2 основан на дозировании в теплоноситель гидразина и, при необходимости, аммиака.
Гидразин-гидрат N2H4 × Н2О – бесцветная жидкость, легко поглощающая из воздуха воду, углекислоту и кислород.
Ткип. = +118,5 0С, Тзам.= – 51,7 0С, М = 50 г/моль, ρ = 1,03 г/см3
Гидразин обладает сильными восстановительными свойствами и слабыми щелочными свойствами, хорошо растворим в воде и спирте. Он токсичен!!!
Назначение вводимых реагентов
Гидразин взаимодействует с кислородом по реакции:
N2H4 + О2 ® N2 + 2Н2О
Скорость этой реакции определяется концентрацией реагирующих веществ, которая весьма мала для условий питательного тракта (концентрация кислорода и гидразина около 2·10-6 моль/л). Константа реакции, естественно, изменяется с повышением температуры, но даже при наиболее благоприятных условиях эти вещества при незначительной их концентрации и за то время, которое предоставлено для реакции, просто не успевают заметно прореагировать.
Гидразин, обладая восстановительными свойствами, в температурном диапазоне (100 – 250) 0С способен восстанавливать легко разрушаемые оксидные пленки СuO, Fе2О3 (продукты стояночной коррозии)
N2H4 + 2Fe2O3 ® 4FeO + N2 + 2Н2О
N2H4 + 2CuO ® 2Cu + N2 + 2Н2О
N2H4 + 2Cu2O ® 4Cu + N2 + 2Н2О
При избытке оксида железа восстановление приводит к образованию магнетита:
N2H4 + 6Fe2O3 ® 4Fe3O4 + N2 + 2Н2О
Присутствие гидразина улучшает свойства пленки окислов на поверхности металла и тем ослабляет переход этих окислов в питательную воду. Этому способствует и поддержание повышенных значений рН воды.
Избыточный гидразин в питательном тракте частично, и в парогенераторе окончательно разлагается с образованием аммиака:
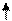 3N2H4 ® 4NH3 + N2
3N2H4 ® 4NH3 + N2
Аммиак, как основание, благоприятствует повышению рН среды, а также расходуется на связывание остатков углекислоты в целях защиты оборудования от коррозии. При этом протекают следующие химические реакции:
NH4OH ® NH4+ + OH - ;
H2CO3 ® H+ + HCO3-
H+ + OH- ® H2O;
HCO3 - + OH- ® CO32- + H2 O
Недостатки гидразинно-аммиачного водно-химического режима:
1. Не полностью предупреждается коррозия медных сплавов, обусловленная присутствием кислорода и аммиака: гидразин, как было сказано, не может полностью связать растворенный кислород; аммиак же способствует коррозии медных сплавов (латуни) по реакции:
2Me + O2 + 8NH3 + 2H2O = 2Me(NH3)42+ + 4OH-,
где Ме – медь и цинк.
Повышенные концентрации аммиака в присутствии растворенного кислорода должны интенсифицировать эту реакцию.
2. Аммиак, обладая высоким коэффициентом распределения (Кd = 10 при 1500С), практически полностью уносится с паром в ПГ, что приводит к снижению фильтроцикла катионитовых фильтров БОУ и уменьшению рН воды ПГ.
3. При гидразинно-аммиачном ВХР не удается избежать коррозионного повреждения коллекторов ПГ, причиной которого является снижение величины рН25 «котловой» воды ПГ.
Основные причины снижения рН25 «котловой» воды ПГ:
- унос с паром аммиака из ПГ;
- присосы охлаждающей воды сульфатного и хлоридного состава в конденсаторах турбины;
- поступление сульфатов в рабочую среду с конденсатоочистки в результате плохого разделения смол во время регенерации (перекрестное загрязнение смол);
- вынос в ПГ мелкой фракции катионита с последующим разложением смолы и накоплением сульфатов в «котловой» воде ПГ.
Для исключения эффекта подкисления «котловой» воды по вышеуказанным причинам с 1992 года специалистами «Атомэнергопроекта» (г. Москва) и Запорожской АЭС проводились работы по коррекционной обработке «котловой» воды ПГ соединениями лития (метабората лития и гидроокиси лития).
Причины использования гидроокиси лития, как корректирующей добавки для второго контура
1. В ряду NaOH – KOH – LiOH уменьшается общая скорость растрескивания углеродистых и нержавеющих сталей, что подтверждено коррозионными испытаниями трубок из аустенитной нержавеющей стали при температуре испытаний 360оС.
В таблице приведены результаты испытаний
| Концентрация | КОН, Время до растрескивания | NaOH, Время до растрескивания | LiOH, Время до растрескивания |
| 0,25 н. | 8 дней<t<10 дней | 4 дня<t<6 дней | Без трещин за 4 месяца |
| 0,025 н. | 3 месяца <t< 6 месяцев | Растрескивания через 4 месяца не отмечено | То же |
| 0,0025 н. | 3 месяца <t< 4 месяцев | Растрескивания через 4 месяца не отмечено | То же |
2. Гидроокись лития образует с конструкционными материалами нерастворимую пленку феррита лития LiFeO2, которая обладает хорошими защитными свойствами, по следующему механизму:
1-ая стадия - образование феррита лития и водорода при одновременном нарушении пассивного состояния сплава.
Fe+LiOH+H2O=LiFeO2+ 3/2H2
2-ая стадия - образование на поверхности металла покрытия из нерастворимого феррита лития.
3-я стадия - формирование сплошного покрытия из Fe3O4 и LiFeO2, при этом скорость реакции 1-ой стадии становится минимальной. Соотношение Li/Fe в покрытии зависит от концентрации лития в воде.
4-ая стадия - взаимодействие магнетита с LiOH по одному из вариантов:
при концентрации LiOH < 1% образуется LiFe5O8 по реакции:
5Fe3O4 + 3LiOH + 2H2O =3LiFe5O8 + OH- + 3H2
при концентрации LiOH > 1% образуется LiFeO2 по реакции:
Fe3O4 + 3LiOH = 3LiFeO2 + H2O + 1/2H2
3. Гидроокись лития обладает хорошими нейтрализующими свойствами против сульфатов и хлоридов, т.к. образует растворимые соли LiCl и Li2SO4,которые выводятся с объема ПГ через систему продувки, что в конечном итоге позволяет увеличивать рН25 продувочной воды и рНt водной среды в объеме, щелях и зазорах ПГ.
Дозирование соединений лития во второй контур производят из расчета поддержания концентрации лития в продувочной воде ПГ на уровне 20-50 мкг/дм3.
Выводы:
1. Применяемый гидразинно-аммиачный ВХР-2, с дополнительной коррекцией гидроксидом лития, направлен на снижение коррозии внутрикорпусных устройств ПГ.
2. Однако он не решает проблемы эрозионно-коррозионного износа элементов оборудования конденсатно-питательного и парового тракта, неэффективен вследствие высокой летучести аммиака (образующего в контуре в результате разложения гидразина), снижения диссоциации аммиака с ростом температуры и невозможности поднять рН за счет аммиака вследствие коррозии медных сплавов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 637; Нарушение авторских прав?; Мы поможем в написании вашей работы!