
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры на скорость реакции
|
|
|
|
В большинстве случаев скорость реакции с повышением температуры увеличивается. Если при повышении температуры не меняется механизм реакции, то увеличение скорости реакции определяется увеличением константы скорости реакции.
Для характеристики зависимости скорости химической реакции от температуры было введено понятие температурного коэффициента скорости (γ), равного отношению константы скорости при температуре (Т + 10) к константе скорости при температуре Т (т.е. γ показывает, во сколько раз изменяется константа скорости при увеличении температуры на 10 градусов):
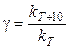 .
.
Экспериментально установлено, что повышение температуры на 10 К в области обычных температур (≈ 300 К) увеличивает скорость большинства гомогенных реакций в 2 ‑ 4 раза, т. е γ = (2 ‑ 4). Это правило называется правилом Вант–Гоффа.
В общем случае отношение констант скорости реакции k 2 и k 1, определенных при двух различных температурах Т 2 и Т 1, равно
 . (22)
. (22)
Однако подобная оценка зависимости скорости реакции от температуры является весьма приближенной. При повышении температуры коэффициент γ не остается постоянным (он уменьшается и при высоких температурах стремится к единице).
Более точную зависимость скорости реакции от температуры дает уравнение Аррениуса.
В дифференциальной форме уравнение Аррениуса имеет следующий вид:
 , (23)
, (23)
где k - константа скорости реакции,
R - универсальная газовая постоянная,
Е - энергия активации химической реакции.
В случае простых реакций величина Е показывает, какой минимальной (избыточной по сравнению со средней) энергией в расчете на 1 моль должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию.
В случае сложных реакций величина Е называется эмпирической или кажущейся энергией активации и в общем случае сложным образом зависит от энергий активации отдельных стадий данной реакции.
Проинтегрировав уравнение (23), получим уравнение Аррениуса в интегральной форме:
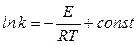 , (24)
, (24)
или, если представить постоянную интегрирования как lnA, получим:
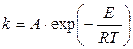 ,
,
где А — предэкспоненциальный множитель.
Физический смысл А зависит от типа реакции, например, для мономолекулярных реакций - это частота колебаний по разрываемой связи (А» 1013 сек-1), бимолекулярных - величина А пропорциональна общему числу столкновений между молекулами реагирующих веществ (А» 10-10 ¸ 10-11 см3/(мол-л·сек).
Интегрирование уравнения (23) в пределах температур от Т 1 до Т 2, дает:
 . (25)
. (25)
На основании экспериментальных данных энергию активации можно определить как аналитически по уравнению (25), так и графическим методом (см. рис. 12). Если реакция подчиняется уравнению Аррениуса, то зависимость ln k от 1/ T должна выражаться прямой линией, что следует из уравнения (24) (рис. 12).
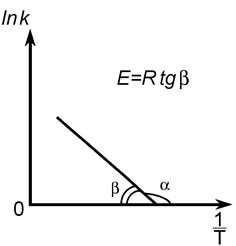
Рис. 12. К расчету энергии активации реакции
по температурной зависимости константы скорости.
Для очень большого числа реакций энергия активации находится в пределах от 60 до 240 кДж/моль, т.е. примерно соответствует энергиям химических связей.
Для реакций с участием активных частиц (свободные атомы, радикалы) энергия активации может быть приблизительно равной нулю.
ЛЕКЦИЯ 11
Теория активных столкновений. Теория активированного комплекса. Кинетика гетерогенных химических реакций.
Катализ: основные положения, гомогенный и гетерогенный катализ, активные центры на поверхности катализатора
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 995; Нарушение авторских прав?; Мы поможем в написании вашей работы!