
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярна структура води і хімічні властивості
У молекулі води дві пари електронів є загальними для ядер водню і кисню. Вони мають сильно витягнуті орбіти і, так як більш електронегативний атом кисню притягує електрони від атомів водню, несуть часткові позитивні заряди, а атом кисню з двома неподіленими парами електронів має частковий негативний заряд.
Оскільки у молекулі води різнойменні заряди просторово розділені, вона при загальній електронейтральності є диполем. Внаслідок того, що орбіти з неподіленими електронами атома кисню лежать у площині, перпендикулярній площині молекули, а кут між ядрами водню становить 104,5°, виникає структура тетраедра з чотирма полюсами електричних зарядів: двома позитивними та двома негативними.
Кожна молекула води, будучи диполем з тетраедричних розподілом електронів навколо атома кисню, може взаємодіяти з чотирма іншими молекулами води за рахунок електростатичної взаємодії атомів Н і О сусідніх молекул (рис. 1).
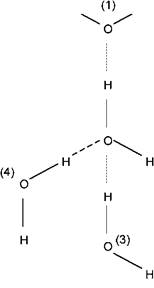 |
Рис. 1. Схема взаємодії молекули води з сусідніми молекулами
Цей зв'язок, який відноситься до водневих, є порівняно слабким зв'язком, так як в рідкій воді енергія, необхідна для його розриву, дорівнює
18,84 кДж/моль (енергія ковалентного зв'язку Н-О в молекулі води становить 460,4 кДж/моль). Водневі зв'язки безперервно виникають і руйнуються.
Іонізація. Оскільки у молекулі води електрони міцніше пов'язані з атомом кисню, відбувається відщеплення протонів. У результаті спостерігається дисоціація молекул води на іони водню і гідроксилу. Але вільний іон Н+ не здатний до самостійного існування і негайно гідратується молекулою води з утворенням іона гідроксонію:
Н+ + Н2О-® Н3О+
Сумарна реакція являє собою перехід протона від однієї молекули води до іншої і утворення іонів гідроксонію і гідроксилу: Н2О + Н2О ® Н3О+ + ОН-
Для простоти викладу гідроксонію (Н3О+) зазвичай позначають як Н+.
При 25°С концентрація водневих або гідроксильних іонів у чистій воді становить 1×10-7 моль/л, що відповідає рН 7.
Вода як розчинник. Полярність молекул води обумовлює їх властивість розчиняти речовини краще, ніж інші рідини. Розчинення кристалів неорганічних солей здійснюється завдяки гідратації входять до їх складу іонів. Добре розчиняються у воді органічні речовини, з карбоксильними, гідроксильними, карбонільними та іншими групами яких вода утворює водневі зв'язки.
Структура льоду та рідкої води. Незважаючи на інтенсивні дослідження, особливості структури води в різних її станах остаточно не з'ясовані. У структурі льоду, отриманого при нормальних умовах тиску, кожна молекула води оточена чотирма іншими, утворюють тетраедр, у центрі якого розташовується молекула води, пов'язана чотирма водневими зв'язками з молекулами води, розташованими у вершинах тетраедра. У цілому утвориться гексагональна кристалічна структура льоду. Середня відстань між атомами кисню для льоду складає 0,276 нм. При плавленні льоду збільшується відстань між атомами кисню (при 15°С воно одно 0,29 нм). Одночасно руйнується близько 15% водневих зв'язків. Замість 12 найближчих молекул у кожної молекули води виявляються від 3,4 до 4,5 сусідніх молекул.
Існують дві групи гіпотез, що пояснюють структуру рідкої води. До гіпотезам першої групи відноситься уявлення О. Я.Самойлова (1946, 1957) про те, що рідка вода має однорідною (ажурною) льодоподібною структурою, в пустотах якої знаходяться мономірні молекули води, що не мають або мають мале число водневих зв'язків. Структура льдоподібного каркаса води може порушуватися тепловим рухом молекул і іонами, перевищують розміри порожнин. Тепловий рух молекул води здійснюється по порожнинах каркасу, не пов'язаних один з одним водневими зв'язками.
Згідно з гіпотез другої групи вода являє собою рівноважну суміш льодоподібною утворень і мономерних молекул. У рідкій воді поява ділянок (кластерів, роїв), об'єднаних взаємодіючими водневими зв'язками, чергується з областями, де водневі зв'язки відсутні або реалізовані лише частково. Чергуються зони, або «мерехтливі кластери», виникають і зникають внаслідок локальних енергетичних флуктуацій. Час життя кластерів 10-10 - 10-11 с. У кожен даний момент часу в освіті «мерехтливих кластерів» бере участь до 2/3 молекул води.
Можливо, що між цими групами гіпотез немає принципових відмінностей. Їх об'єднують такі уявлення: існування водневих зв'язків, які беруть участь у створенні організованих структур;існування двох типів структур: з упорядкованою орієнтацією молекул (льодоподібною структура, кластери) і невпорядкованою структури з малим числом водневих зв'язків; руйнівний вплив теплового руху молекул на структуру воду; кооперативні властивості води.
Розчини електролітів. У розчинах, що містять іони, структура води істотно змінюється. У розведених розчинах (0,1 моль/л) це відбувається завдяки зарядженим іонів. Ефект залежить від поляризуючої сили іона, яка визначається щільністю заряду (відношення заряду іона до його радіусу). Маленькі іони з великою щільністю заряду сильніше діють на структуру чистої води в порівнянні з великими іонами, що мають малу щільність заряду. І ті й інші руйнують структуру води: перші притягують молекули води, другі при впровадженні у воду з-за великого розміру руйнують льодоподібною каркас. При цьому може змінюватися в'язкість водного розчину: структура, створювана слабогідратованими великими іонами (з малим зарядом), робить в'язкість розчину нижче в'язкості чистої води, а більш щільна структура, утворена гідратованих іонами, зумовлює більш високу в'язкість, ніж в чистій воді.
В електричному полі катіона всі найближчі молекули води орієнтуються негативними полюсами всередину, а навколо аніону всередину спрямовані позитивні полюси молекул води. Цей внутрішній, міцно пов'язаний з іоном шар молекул води називають первинною, або ближній, гідратацією (сольватацією). У процесі електрофорезу він рухається разом з іоном як одне ціле. Однак іон, пов'язуючи певне число молекул води з свого безпосереднього оточення, в результаті іон-дипольні взаємодії орієнтує також більш далеко розташовані диполі води. Цю гідратацію називають вторинною або дальній.
У стані первинної гідратації молекули води мають знижену рухливість і знаходяться в обмінному рівновазі з найближчими молекулами. А молекули вторинної гідратної оболонки, зберігаючи рухливість, під поляризуючим впливом іона прагнуть до деякої впорядкованості, що порушує вихідну структуру води. Із зовнішнього боку цього шару вода зберігає незмінну природу.
Воду, пов'язану з іонами, називають також осмотично зв'язаної. Вона є важливою складовою осмотичного тиску в клітинах живих організмів.
У міру підвищення концентрації розчину (до 1,5-2 міль/л) вторинні гідратів оболонки іонів перекриваються і вода з власною структурою перестає існувати: спостерігається перехід від структури чистої води до структури кристалогідрату. Чим більше іонів в розчині, тим більше порушена структура води і, отже, тим менше енергії необхідно для руйнування залишилися водневих зв'язків і підвищення температури розчину.
Вплив гідрофобних радикалів на структуру води. При розчиненні у воді речовини з великою гідрофобним радикалом, наприклад, тетрабутілам-монійброміда (С4Н9)NBr, і зі збільшенням його концентрації в розчині теплоємність розчину підвищується. Це пояснюється тим, що неполярні молекули збільшують ступінь структурної організації води. Навколо них утворюються кристалогідрати з пентагональними осередками. Наприклад, (С4Н9)NBr утворює кристалогідрат, маса якого на 90% складається з кристалічної води. Вода в цьому кристалі має високу теплоємність: кристал плавиться не при 0°С, як лід, а при 30°С.
Описано випадки закупорки льодом труб газопроводу при 20°С (освіта кристалогідрату близько молекул метану), а також замерзання зерна і пошкодження посівів від появи льоду в тканинах при 4,5°С (освіта кристалогідратів близько неполярних радикалів макромолекул білків).
Розчини білків. У білках гідратація обумовлена взаємодією молекул води з гідрофільними (іонними та електронейтральний) і гідрофобними (неполярними) групами та її іммобілізацією в замкнутих просторах всередині макромолекул при їх конформаційних перебудовах.
При гідратації іонної (взаємодія з КН3+, СОО- - групами) та електронейтральної (з СООН, ВІН, СО, NН, КН2, СОКН2 - групами) молекули води електростатично зв'язуються і утворюється мономолекулярний шар первинної гідратації. Число іонізованих груп в білку залежить від рН середовища. Найменш гідратованих білок в ізоелектричній точці, при якій відзначається також найнижча розчинність білків. Гідрофобні групи, наприклад аланіну, збільшують структурованість води в цих ділянках молекули білка.
Крім гідрофобних груп у молекулах білків, на структурованість води впливає гідрофобна ліпідна фаза мембран.
Іммобілізована вода, що опинилася замкненою всередині макромолекул, може брати участь в утворенні шару первинної гідратації, а решта її частина зберігає властивості звичайної води, але з обмеженою рухливістю.
Розчинність білків у воді варіює в широких межах. Визначеної залежності між гідратацією і розчинність білків не спостерігається. Наприклад, сухий колаген може зв'язати набагато більше води, ніж сухий сироватковий альбумін. Однак колаген розчиняється у воді, а альбумін розчиняється в ній легко. На можливість гідратації білків за рахунок пептидних зв'язків вказує той факт, що штучний поліпептид нейлон, що не містить бічних йоногенних ланцюгів і гідрофільних груп, здатний зв'язувати воду. Залежно від фізико-хімічних властивостей макромолекул (наявність полярних, неполярних, іонізованих груп), конформаційного стану і зовнішніх умов (рН, іонний склад) може спостерігатися більша або менша зв'язування води та освіта стабільної льдопобной структури.
Таким чином, незважаючи на величезну кількість робіт, присвячених структурі води та особливостей її впливу на процеси формування, стабілізації і активного функціонування різних біологічних структур, зазначена проблема і в даний час залишається ще залишається предметом дискусії. Даний факт уже сам по собі здається дивним, особливо на тлі досягнень молекулярної біології по розшифровці значно більш складних структур і щодо з'ясування механізмів їх дії. Однак у випадку води існують певні труднощі, які обумовлені багатостороннім характером її впливу на біологічні системи.
|
|
Дата добавления: 2014-01-07; Просмотров: 2466; Нарушение авторских прав?; Мы поможем в написании вашей работы!