
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коефіцієнт активності розчинених компонентів в водних розчинах
|
|
|
|
Наявність в розчинах взаємодії між частинками розчиненої речовини і розчинника веде до відхилення властивостей реальних розчинів від властивостей ідеальних розчинів. Всі ці відхилення звичайно об‘єднуються в один фактор, що називається коефіцієнтом активності, що пов’язує концентрацію компонента із його діючою концентрацєю – активністю
 aі = γі·mі
aі = γі·mі
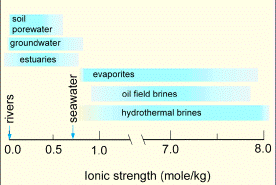
Рис. 6.9. Іонна сила природних вод
Коефіцієнт активності залежить від загальної концентрації фонового розчину (наприклад розчину NaCl, чи як для морської води Ca-Na-Mg-Cl-HCO3-SO4) і заряду катіонів цього розчину. Інтегруючим показником при цьому є іонна сила I, що визначається за рівнянням:
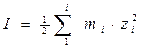 , m – моляльна концентрація іону, z – заряд іону
, m – моляльна концентрація іону, z – заряд іону
Цей вираз можна застосовувати лише для розбавлених розчинів (< 1 m).
Маючи значення іонної сили із хімічних аналізів, значення коефіцієнту активності γі можна розрахувати виходячи із декількох апроксимаційних рівнянь, що ґрунтуються на положеннях теорії електростатичних взаємодій в розчині - теорії Дебая-Гюкеля. Згідно цієї теорії, електроліти в розчині дисоційовані повністю; додатні та від‘ємні іони закономірно чергуються в просторі. Навколо кожного із іонів формується сфера, де поява протилежно заряжених частинок різко зростає (іонна атмосфера). Термодинамічні властивості розчинів пов‘язуються із параметрами іонної атмосфери - її розмірами та густиною. Рівняння, вперше запропоноване у 1923 році, уточнювалося різними дослідниками. Кожне із наведених нижче рівнянь дійсне тільки в певному інтервалі значень іонної сили.

де A - параметр, що залежить від властивостей розчинника і температури; zі - заряд іону; І - іонна сила розчину, å - середня віддаль наближення іонів; B - параметр, що визначається залежністю густини і діелектричної сталої води в залежності від температури і звичайно є протабульований (Helgeson, Kіrkham, Flowers, 1981); bі - напівемпіричний коефіцієнт.
Рівняння WATEQ працює для розчинів із іонною силою менше 1 m. В таких розчинах іони оточені сольватацій ними оболонками. Збільшення концентрацій призводить до руйнування сольватацій них оболонок і іон-іонної взаємодії. Для таких розчинів, таких як росоли нафтових родовищ чи росоли соляних озер (лагун) розроблене рівняння Пітцера (Pitzer 1973).
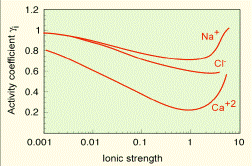
| Рис. 6.10. Зміна конфіціентів активностей деяких іонів залежно від іонної сили розчину |
У сильно концентрованих розчинах різко зменшується активність води, так як більшість молекул H2O зв’язані у сольватацій них оболонках. Відсутність вільних молекул воли – причина кристалізації ангідриту CaSO4 у високо-концентрованих росолах евапоритових басейнів. Гіпс, на відміну, кристалізується на початку евапоритового процесу при відносно низькій концентрації розчину.
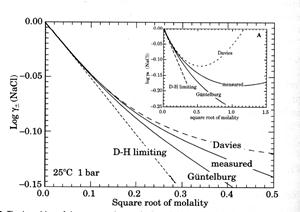
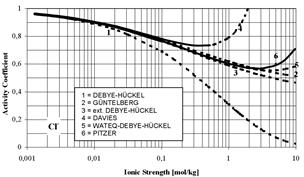
| Рис. 6.11. Співвідношення спостережуваного коефіцієнту активності для розчину NaCl і значень, розрахованих за рівняннями 14, 15 і 16. |
| 
|
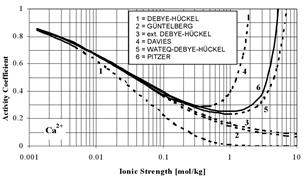
| Рис. 6.12. Порівняння залежностей коефіцієнтів активності Ca2+ і Cl- від іонної сили розчину CaCl2, розрахованих за різними теоріями електростатичних взаємодій в розчині і за рівнянням Пітцера, яке найбільш точно відповідає реальним варіаціям. |
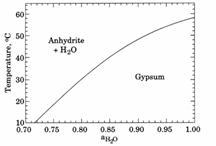
Рис. 6.13. Стабільність гіпсу і ангідриту як функція температури і активності H2O при 1 бар (із Hardie, 1967).
У чистій воді гіпс переходить в ангідрит при 58°С. Із насиченого розчину NaCl ангідрит кристалізується при 10°С.
Наведіть приклади природних водних розчинів
Чому вода є універсальним розчинником?
Що таке діелектрична стала води?
Що таке гідратація іонів у водному розчині?
Наведіть приклади гідратаційних комплексів
Що таке константи дисоціації?
Які ви знаєте розчинні форми в природних геохімічних системах?
Що таке комплексні сполуки у водних розчинах?
Назвіть основні розчинні форми у морській воді
Що таке коефіцієнт активності розчинних компонентів?
Що таке іонна сила розчину?
Що таке ефект висолювання?
Що таке стала Генрі?
Дайте характеристику природних водних розчинів
Поясніть природу високої розчинної здатності води
Як залежить діелектрична стала води від температури і які це має наслідки?
Опишіть основні особливості гідратації іонів у водному розчині
На прикладі природніх процесів охарактеризуйте поняття константи дисоціації
Які ви знаєте розчинні форми в природних геохімічних системах?
Охарактеризуйте основні закономірності формування комплексних сполук у водних розчинах
Який зв’язок між розчиненням мінералів і комплексоутворенням?
Які чинники контролюють активність розчинних компонентів у водних розчинах?
Від чого залежить розчинність газів у воді?
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3141; Нарушение авторских прав?; Мы поможем в написании вашей работы!