
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Діаграми pH-pC
|
|
|
|
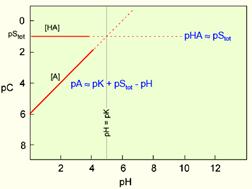
| Рис. 2
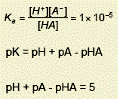
|
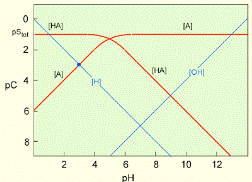
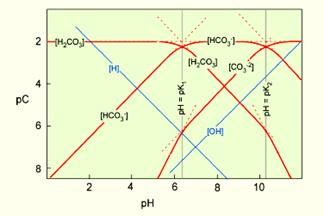
| Розчинення CO2 у воді відбувається за схемою (pK= -log K) CO2(газ) + H2O = H2CO30 pK = 1.46 H2CO30 = HCO3- + H+ pK = 6.34 HCO3- = CO32- + H+ pK = 10.33 Константи рівноваги зв’язані із активністю протону. Таким чином ми можемо визначити значення pH для областей переважання кожного із трьох карбонатних розчинних форм H2CO30, HCO3-, CO32-. |
| Якщо прийняти, що a H2O = 1, то ми можемо записати
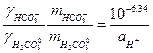
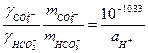 якщо прийняти коефіцієнти активності рівними 1, рівняння спрощуються і ми можемо побудувати графік залежності pC-pH.
якщо прийняти коефіцієнти активності рівними 1, рівняння спрощуються і ми можемо побудувати графік залежності pC-pH.
|
Із графіка ми бачимо, що існують дві точки із pH 6,3 і 10,3, в яких відбувається зміна домінуючих розчинних сполук в системі.
 Рівняння балансу мас для розчиненої вуглекислоти виглядатиме наступним чином
Рівняння балансу мас для розчиненої вуглекислоти виглядатиме наступним чином
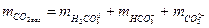
Рівняння балансу заряду
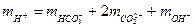
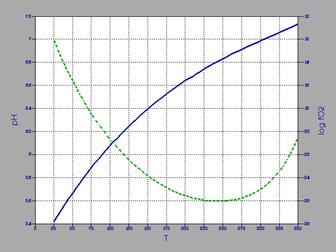
Рис.3. Змiна точки нейтральностi pH i fO2 в залежностi вiд температури
Точка нейтральності чистої води змінюється із температурою. При 25°С вона рівняється 7,0: і поступово зменшується із ростом температури, досягаючи мінімуму5,6 при 250°С, потім зростає до 6,1 при 350°С
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 408; Нарушение авторских прав?; Мы поможем в написании вашей работы!