КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обрыв цепи
|
|
|
|
..........
Цепные реакции. Теория простых и разветвленных цепей. Теория взрывов и воспламенений. Тепловой взрыв
Опытным путем было установлено, что целый ряд химических реакций протекает таким образом, что вначале в системе образуются активные частицы, чаще всего свободные атомы и радикалы, которые имеют свободные валентности и поэтому очень реакционноспособны. Активные частицы вступают в реакции, при которых вновь возникают свободные атомы и радикалы. Эта последовательность реакций, которые периодически повторяются, называется цепной реакцией.
Таким образом, зарождение очень небольшого количества реакционноспособных частиц приводит к превращению большого количества исходных продуктов. Цепные реакции обычно протекают циклически. Активная частица, регенерированная в конце цикла, дает начало новому циклу, в конце которого снова происходит регенерация активной частицы.
Несмотря на то, что процесс образования свободного атома или радикала требует большой затраты энергии, легкость взаимодействия свободных радикалов с насыщенными молекулами и регенерация при этом новых свободных радикалов приводит к тому, что скорость цепного процесса может оказаться больше скорости нецепного процесса. Этим можно объяснить большую распространенность цепных химических реакций.
Впервые мысль о возможности протекания химических реакций по механизму, который теперь называют цепным, была высказана Д.И.Менделеевым при объяснении им особенностей реакции окисления оксида углерода кислородом в присутствии паров воды.
Типичным примером цепной реакции может служить реакция соединения хлора с водородом на свету. Если осветить на очень короткий промежуток времени (например, искрой) смесь газообразных хлора и водорода, то произойдет взрывная реакция образования хлористого водорода. Это объясняется тем, что вслед за элементарным фотохимическим актом, заключающимся в разложении поглотившей свет молекулы хлора на атомы, продукты этой первичной реакции - атомы хлора и продукты вторичной реакции - атомы водорода - вступают в длинную цепь реакций с молекулами хлора и водорода, не поглотившими света. Схема этой реакции, предложенная Нернстом, может быть записана так:
+ hn
Cl2 ® 2 Cl Зарождение цепи
Cl + H2 ® HCl + H Развитие
H + Cl2 ® HCl + Cl цепи
2 Cl ® Cl2 Обрыв
2 H ® H2 цепи
В этой схеме можно выделить три группы реакций:
1. Первичная реакция диссоциации хлора под действием света - реакция зарождения цепи. Характерной особенностью данной реакции является то, что в результате нее возникают активные центры. Активными центрами могут быть свободные атомы (как в рассматриваемой реакции), радикалы или химически активные молекулы, обладающие избытком внутренней энергии.
2. Под влиянием инициирующей реакции (1) возникают последовательно идущие один за другим циклы - развивается цепная реакция (развитие цепи):
Cl ® H ® Cl ® H ® Cl ® H ® ...
3. Реакции, которые приводят к гибели активных частиц, а при достаточной интенсивности - и к прекращению цепной реакции, называются реакциями обрыва цепи. Число циклов от момента зарождения цепи до ее обрыва называется длиной цепи.
Известно, что рекомбинация атомов как бимолекулярный процесс в объеме невозможна, так как энергии, выделяющейся при образовании молекулы, достаточно для разрыва возникшей связи. Для стабилизации возникшей молекулы необходимо присутствие третьей частицы, которая воспринимала бы избыток энергии. Такой третьей частицей может быть молекула постороннего вещества или стенка реакционного сосуда.
При низких давлениях активные центры гибнут на стенках, при высоких давлениях происходит тримолекулярный обрыв, например:
Cl + Cl + M ® Cl2 + M,
H + H + M ® H2 + M,
где М - третья частица. В присутствии кислорода обрыв цепи происходит вследствие реакции
Н + О2 + М ® НО2· + М
с последующей гибелью НО2· на стенках или по реакции
НО2· + Н ® Н2 + О2
Поэтому для цепных реакций характерна зависимость скорости реакции от величины удельной поверхности реакционного сосуда, от присутствия какого-либо инертного вещества и от давления или концентрации реагирующих веществ, причем реакция протекает как взрывная только по достижении определенных значений давления (так называемые критические пределы взрывных давлений). Зависимость скорости реакции от диаметра сосуда и добавки инертных веществ хотя и служит признаком цепной реакции, но этот признак не является необходимым. Например, в цепных реакциях, когда цепи зарождаются и гибнут на стенках, такая зависимость может и не наблюдаться.
Если в результате одного элементарного акта возникают две или больше химически активные частицы, то процесс называется разветвленным цепным процессом. При этом число активных центров, а следовательно, и скорость процесса будут лавинообразно нарастать до того момента, когда в результате израсходования исходного вещества скорость процесса начнет уменьшаться. Примером таких процессов могут служить реакции сгорания углеводородов. Так, при окислении метана возможна реакция возникающего при высоких температурах радикала НО2· с одним из первичных продуктов окисления - формальдегидом и кислородом с образованием трех радикалов:
НО2· + НСОН + О2 ® СО2 + 3НО·
Если каждый элементарный акт приводит к разветвлению цепи, то наблюдается реакция с сильно разветвлёнными цепями (рис. 11, а). Примером такого типа реакций может служить реакция окисления водорода при низких давлениях и температурах около 900оС. При этом в результате одного элементарного акта возникают два радикала:
Н + О2 ® НО· + О
О + Н2 ® НО· + Н
НО· + Н2 ® Н2О + Н
Если разветвление происходит не при каждом элементарном акте реакции, а лишь изредка, то наблюдаются реакции с редко разветвлённой цепью (рис. 11, б). Примером такой реакции может быть реакция окисления водорода при высоких давлениях и температуре около 500оС:
Н + О2 + М ® НО2· + М
НО2· + Н2 ® Н2О2 + Н
Н + О2 ® НО· + О
НО· + Н2 ® Н2О + Н
О + Н2 ® НО· + Н
Реакция Н + О2 ® НО· + О идет в этих условиях медленнее, чем реакция Н + О2 + М ® НО2· + М, приводя к редким разветвлениям.
а |  б
б
| |||
| Рис. 11. Схема разветвленного цепного процесса: а – реакция с сильно разветвленной цепью, б – реакция с редко разветвленной цепью |
Разветвление может происходить не только в результате образования двух или большего числа атомов или радикалов при гибели одного, но и при реакциях возбужденной молекулы продукта с образованием атомов или радикалов. Эта реакция может быть или реакцией мономолекулярного распада возбужденной молекулы, или бимолекулярной реакцией ее с молекулой исходного вещества. Так, одна из реакций фторирования
R + F2 ® RF + F
настолько экзотермична, что возникающая молекула RF обладает энергией, превосходящей энергию связи R – F, поэтому молекула RF распадается по мономолекулярному закону на радикал R и атом фтора, что приводит к разветвлению цепи.
Иногда реакции становятся разветвленными за счет образования малоустойчивых молекул промежуточного продукта реакции, которые распадаются с образованием свободных радикалов. Такие реакции часто называют реакциями с вырожденным разветвлением. В этих случаях разветвления всегда редки. Примером может быть реакция окисления метана, протекающая по схеме
·СН3 + О2 ® СН3ОО·
СН3ОО· + СН4 ® СН3ООН + ·СН3 и т.д.
Возникающий пероксид может с небольшой долей вероятности распадаться с образованием свободных радикалов, что и приводит к вырожденному разветвлению, протекающему по следующей схеме:
СН3ООН ® СН3О· + ·ОН
СН3О· + СН4 ® СН3ОН + СН3·
·ОН + СН4 ® ·СН3 + Н2О
Пероксид может распадаться и другим путем, например
СН3ООН ® СН2О + Н2О
Если же в результате реакции возникновения цепи образуется свободный радикал или атом с одной свободной валентностью, то цепи будут неразветвленными, как это видно на примере уже рассмотренной реакции хлора с водородом.
Цепные процессы следует отличать от каталитических и автокаталитических, хотя развитие последних также носит циклический характер. Одно из основных отличий каталитических реакций от цепных заключается в отсутствии реакции зарождения цепи, так как один из компонентов промежуточных продуктов присутствует в числе исходных продуктов и носит название катализатора. Кроме того, для каталитических реакций не характерны реакции обрыва цепи.
Кроме такого различия цепных и каталитических реакций по числу и характеру элементарных звеньев, существует еще одно значительное: в цепных реакциях одна реакция, протекающая самопроизвольно, то есть с уменьшением энергии продуктов, может обеспечить энергией другие реакции, идущие с увеличением энергии.
Всякая реакция может идти как по механизму перегруппировки связей, так и по цепному с образованием и участием в процессе свободных атомов и радикалов. Вероятность цепного механизма больше, так как радикалы обладают большей реакционной способностью и при реакции одновалентного свободного радикала с молекулой свободная валентность не уничтожается, что обеспечивает развитие цепи.
Например, реакция распада ацетальдегида, протекающая в газовой фазе при температуре порядка 500оС, может идти по молекулярному механизму непосредственного распада каждой отдельной молекулы с образованием метана и оксида углерода
СН3СНО ® СН4 + СО
и по цепному механизму
СН3СНО ®  +
+ 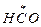 (зарождение цепи)
(зарождение цепи)
 + СН3СНО ® СН4 +
+ СН3СНО ® СН4 + 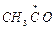 (развитие цепи)
(развитие цепи)
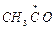 ®
®  + СО и т.д.
+ СО и т.д.
 +
+  ® С2Н6 (обрыв цепи)
® С2Н6 (обрыв цепи)
Опыт показывает, что реакция протекает по цепному механизму. Несмотря на очень малую скорость зарождения цепи, цепная реакция протекает во много раз быстрее, чем простая.
Другим примером, показывающим возможность протекания реакции по молекулярному или цепному механизму, является реакция образования галогенводородов. Как мы выше видели, реакция образования хлористого водорода из молекулярных водорода и хлора протекает как типичная цепная реакция. В случае реакции брома с водородом вследствие эндотермичности реакции
Br + H2 ® HBr + H, DН = 62,8 кДж/моль,
длина цепей много меньше, чем в реакции хлора с водородом. Реакция иода с водородом протекает по молекулярному механизму, являясь типичным примером бимолекулярной реакции. Это происходит вследствие большой эндотермичности процесса
J + H2 ® HJ + H, DН = 138,1 кДж/моль.
Образующиеся атомы иода рекомбинируют в молекулы, не успев вступить в реакцию с молекулярным водородом.
Цепными являются многие процессы окисления и горения, крекинга, полимеризации, галоидирования и другие.
Опыт показывает, что при нагревании паров углеводородов, особенно при низком давлении (0,13 – 0,27 кПа или ниже), образуются свободные радикалы. Поэтому в основу объяснения кинетики крекинга углеводородов была положена идея цепного характера процесса, ибо схемы с участием свободных радикалов хорошо согласуются с опытными данными о выходах конечных продуктов различной природы. Например, при крекинге пропана первые стадии процесса могут быть следующими:
СН3СН2СН3 ®  +
+ 
 ® СН2 = СН2 + Н
® СН2 = СН2 + Н
после чего идут реакции с участием метильного радикала
СН3СН2СН3 +  ® СН4 +
® СН4 + 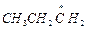
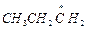 ® СН2СН2 +
® СН2СН2 +  и т.д.
и т.д.
и реакции с участием атома водорода
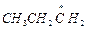 + Н ® Н2 +
+ Н ® Н2 + 
 ® СН3СН = СН2 + Н и т.д.
® СН3СН = СН2 + Н и т.д.
Из приведенной схемы течения реакции вытекает правильное соотношение между количествами водорода, пропилена, метана и этилена, которые являются конечными продуктами термического крекинга пропана.
Несмотря на большую эндотермичность процесса образования свободных радикалов, которая соизмерима с энергией разрыва соответствующей связи, то есть имеет порядок десятков кДж/моль, относительная легкость осуществления промежуточных звеньев делает цепной процесс значительно более выгодным, чем простой мономолекулярный распад по реакции
С3Н8 ® С3Н6 + Н2
С3Н8 ® СН4 + С2Н4
Интересно отметить, что цепная схема течения реакции термического разложения углеводородов приводит во многих случаях к уравнению кинетики, соответствующему реакции первого порядка.
Имеющие большое практическое значение реакции полимеризации очень часто протекают с участием свободных радикалов. Такая полимеризация получила название радикальной. Зарождение цепей, связанное с образованием свободных радикалов, может произойти под действием света, g-излучения, b- или a-частиц, нейтронов, электрического разряда, а также под действием нагревания (термическая полимеризация) или под влиянием инициаторов (инициированная полимеризация). Если применяются инициаторы, свободные радикалы возникают в результате диссоциации молекул-инициаторов; инициаторами чаще всего являются перекиси.
Реакции, инициированные добавлением веществ или воздействием излучений, способствующих появлению радикалов в системе, называют индуцированными цепными реакциями.
Появление радикалов не всегда связано с возникновением цепного химического процесса. Всё зависит от реакционной способности возникающих радикалов и от теплового эффекта реакции с участием радикала. Если к смеси H2 + Cl2 добавить O2, то цепи обрываются (смотри вышеприведённые реакции); HO2· - малоактивный радикал, не способный продолжать цепь. Радикалы HO2· рекомбинируют в объеме или на стенках. Другие примеры малоактивных радикалов: аллильный радикал CH2=CH-CH2· (свободная валентность сопряжена с двойной связью); NO·. Радикал может оказаться малоактивным и в том случае, если реакция, в которую он вступает, заметно эндотермична (пример – рассмотренная выше реакция молекулярного водорода с иодом).
В цепных реакциях очень распространено явление отрицательного катализа веществами, соединяющимися с активными переносчиками реакции и вызывающими обрыв цепей. Реакции окисления жидких углеводородов тормозятся фенолом, аминами и другими веществами, называемыми ингибиторами.
Цепными реакциями являются реакции деления 233U, 235U, 239Pu. В процессе деления ядра урана или плутония, вызванного захватом нейтрона, происходит выделение не только значительного количества энергии, но также и некоторого числа (от двух до трех) нейтронов. Эти нейтроны захватываются другими ядрами, которые при определенных условиях начинают делиться. Поэтому число нейтронов, возникающих в результате деления, возрастает в геометрической прогрессии. Таким образом, если преобладающее число нейтронов используется для новых актов деления, имеет место типичный разветвленный процесс, в котором роль промежуточного вещества играют нейтроны. Этот процесс и используется для получения атомной энергии.
Как уже говорилось, одним из процессов, приводящих к обрыву цепи, является захват свободных радикалов стенкой. Процесс обрыва цепи в этом случае является гетерогенным и складывается из двух процессов: а) диффузии радикалов к стенке и б) захвата радикала стенкой. Более медленный из этих процессов определяет скорость всего процесса в целом. Если медленным процессом является диффузия, то процесс обрыва цепи называется диффузионным; его скорость определяется скоростью диффузии свободных радикалов к стенке. Если же медленным процессом является реакция взаимодействия радикалов со стенкой, то скорость обрыва определяется этой скоростью и не зависит от скорости диффузии. Таким образом, лимитирующей стадией является кинетическая стадия, и обрыв называется кинетическим обрывом. Кинетический обрыв реализуется, когда вероятность прилипания атома или радикала к стенке при соударении с ней меньше 10–3. В этом случае происходит более тысячи соударений атома или радикала со стенкой, прежде чем произойдет его гибель. Поэтому можно с достаточным приближением считать, что концентрация атомов или радикалов в объеме стационарна, то есть не зависит от времени. Число ударов атомов или радикалов в единицу времени о стенку площадью S будет равно
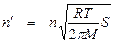 , (1)
, (1)
где п – общее число атомов или радикалов в единице объема; Т – абсолютная температура; М – молярная масса атомов или радикалов.
Скорость гибели атомов или радикалов будет равна произведению числа ударяющихся атомов или радикалов о стенку в единицу времени на вероятность прилипания e, то есть будет равна п ¢ e.
Скорость образования атомов или радикалов в единицу времени в единице объема обозначим v о, тогда число возникающих атомов или радикалов в объеме сосуда V будет равно V v о. Как уже сказано, из-за малой вероятности гибели радикалов на стенке устанавливается стационарное состояние, то есть скорость возникновения атомов или радикалов становится равной скорости их гибели:
 . (2)
. (2)
Подставляя выражение (2) в (1), найдем, что число атомов или радикалов в объеме в стационарном состоянии равно
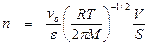 . (3)
. (3)
Следовательно, число гибнущих радикалов в сосуде объемом и площадью стенок S в единицу времени в кинетической области прямо пропорционально площади поверхности реакционного сосуда. Кроме того, скорость обрыва зависит от e – вероятности захвата свободного радикала. Эта величина зависит от материала поверхности стенки и изменяется при различной обработке последней. Так как скорость цепной реакции прямо пропорциональна числу активных частиц, то, как видно из выражения (3), она оказывается обратно пропорциональной удельной поверхности S реакционного сосуда.
Реакции обрыва цепи, скорости которых прямо пропорциональны концентрации свободных радикалов, называются реакциями линейного обрыва цепи. Кинетический обрыв на стенках реакционного сосуда является линейным. Линейный обрыв наблюдается и тогда, когда радикал гибнет за счет взаимодействия с валентно-насыщенными атомами, если в результате образуется малоактивный радикал, или за счет взаимодействия с ионами металлов переменной валентности. В первом случае образование малоактивного радикала приводит к ингибированию цепного процесса.
При диффузионном обрыве скорость гибели радикалов на стенке велика и вероятность прилипания атома к стенке близка к единице. Скорость обрыва цепи лимитируется диффузией атома или радикала к стенке.
Знание закономерностей обрыва цепи позволяет устанавливать, от каких параметров и как зависит скорость цепной реакции. На стенках при определенных условиях происходит не только гибель активных частиц, но и их генерация.
Обрыв цепи может происходить и в результате насыщения свободных валентностей при взаимодействии двух свободных радикалов. В этом случае обрыв цепи является реакцией второго порядка. В случае, если скорость обрыва цепи оказывается прямо пропорциональной произведению концентрации радикалов или квадрату концентрации одного из радикалов, она называется реакцией квадратичного обрыва цепи. Квадратичный обрыв цепи характерен для реакций в жидкой фазе, когда диффузия свободных радикалов к стенкам затруднена.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3620; Нарушение авторских прав?; Мы поможем в написании вашей работы!