
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Недостаточность модели однородной поверхности в катализе и адсорбции
|
|
|
|
Связь между энергией активации и предэкспоненциальным множителем
Впервые Констейбл, а вслед за ним и другие исследователи обратили внимание на то, что почти во всех случаях между параметрами Z и Е уравнения Аррениуса
k = Z e – E / RT (6)
для реакции, изучаемой на катализаторах различной химической природы, или по-разному обработанных, имеется связь, которая выражается уравнением
Z = a e E/n (7)
или в логарифмическом виде
ln Z = ln a + E/ n, (8)
где а и 1/ n – константы.
Наличие такой зависимости тем более удивительно, что, казалось бы, никакой связи между Е и Z не должно быть, так как Е непосредственно связано с адсорбционным потенциалом активных центров, а Z с точностью до множителя пропорциональности есть число активных центров на единице поверхности или единице массы катализатора. До сих пор полного теоретического истолкования этой интересной опытной закономерности нет.
Между тем ее существование приводит к весьма большим трудностям в сравнительной оценке активности катализаторов. Действительно, переход к катализатору с большей энергией активации, казалось бы, должен был привести к меньшей общей активности его. Однако одновременное и, как правило, пропорциональное увеличение предэкспоненционального множителя нивелирует действие активационного члена и приводит примерно к тому же значению активности катализатора.
Наиболее рациональное объяснение связи между Е и Z на основе теории активных центров дано Швабом.
Как показано выше, маловероятно, чтобы вся поверхность катализатора была активна, а существуют активные центры. Эти центры обладают различной энергией. По статистическим и термодинамическим причинам они должны быть тем более многочисленны, чем ниже их энергия. Увеличение числа активных центров соответствует увеличению значения Z. В то же время активные центры должны быть тем менее эффективны, чем ниже их энергия, то есть с уменьшением энергии активных центров растет значение Е. Таким образом, становится понятным, что высокая энергия активации связана с высоким значением Z.
Рассмотренная выше теория кинетики гетерогенных процессов основывалась на трех основных положениях.
1. Поверхность однородна в каталитическом и адсорбционном отношении, то есть все адсорбционные центры характеризуются одними и теми же теплотами адсорбции, и на всех каталитически-активных центрах процесс идет с одной и той же энергией активации.
2. Между адсорбированными молекулами на поверхности нет какого-либо взаимодействия. Существуют только силы связи между адсорбционными центрами и молекулами адсорбированного вещества.
3. При адсорбции поверхность покрывается мономолекулярным слоем адсорбированного вещества.
Отсюда следует уравнение Ленгмюра
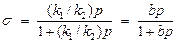 , (9)
, (9)
на использовании которого и были построены все кинетические расчеты. Адсорбционный коэффициент b = k 1 / k 2, если адсорбция обратима, есть не что иное, как константа равновесия между веществом на поверхности и в газовой (или жидкой) фазе:
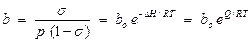 , (10)
, (10)
где b о – коэффициент, связанный с энтропией адсорбции; DН – энтальпия адсорбции; Q – теплота адсорбции.
Таким образом, применимость уравнения Ленгмюра требует постоянства b, то есть постоянства Q для всех адсорбционных центров на поверхности. Между тем мы уже встречались с примерами, когда уравнение Ленгмюра (см. рис. 18) не выполняется, а теплоты адсорбции закономерно изменяются с ростом степени заполнения поверхности адсорбированным веществом. Очевидно, что в этих случаях и для описания каталитического процесса могут стать непригодными кинетические методы, развитые на основании применения уравнения Ленгмюра.
При описании кинетических закономерностей таких реакций можно исходить из двух предпосылок: с одной стороны, принять, что поверхность неоднородна каталитически или адсорбционно, то есть отвергнуть первое положение теории Ленгмюра; с другой – учесть, что между молекулами в адсорбционном слое имеет место взаимодействие, то есть отвергнуть второе положение теории Ленгмюра.
Адсорбция и катализ на неоднородных поверхностях
Теория адсорбционных и каталитических явлений на неоднородных поверхностях в основном разработана советскими исследователями. Наиболее систематически статистические методы учета неоднородности рассмотрены в работах С.З.Рогинского.
В результате генезиса на поверхности образца (адсорбента или катализатора) могут иметь место различные нарушения кристаллической решетки, микропоры, разрывы, избыточные атомы, частицы примеси и т.д. Каждое из этих нарушений, с одной стороны, может обладать различными адсорбционными и каталитическими свойствами, с другой – изменять свойства близлежащих участков поверхности.
Наиболее удобно различие в свойствах участков поверхности описывать с помощью двух величин: теплоты адсорбции Q для адсорбционных свойств и энергии активации Е для каталитических свойств. Участки с различными значениями Q или Е расположены хаотически, но они проявляются группами с одинаковым (или приблизительно одинаковым) значением Q (или Е). Например, при адсорбции вначале происходит адсорбция на участках с наибольшим значением Q, затем по мере их заполнения на участках с все более и более низким значением теплоты адсорбции.
Чтобы вывести определенные количественные закономерности, прежде всего надо знать, какое число центров адсорбции или катализа обладает данным значением Q или Е. Если по условиям опыта или фактическому состоянию активной поверхности центры адсорбции можно подразделить на ряд групп, внутри которых теплота адсорбции постоянна (или в среднем постоянна), то получим ряд участков с различными значениями Q1, Q2,..., Q i теплот адсорбции. Для каждого из этих участков в отдельности применимо уравнение Ленгмюра
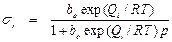 . (11)
. (11)
Для того чтобы получить долю всей поверхности с неоднородным составом адсорбционных центров, занятую адсорбированным веществом, необходимо просуммировать выражение (11) по всем участкам с разными значениями теплот адсорбции:
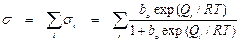 . (12)
. (12)
Функция распределения для различных поверхностей может иметь различное аналитическое выражение. Практически пользуются формулами, с большей или меньшей точностью выражающими действительное распределение. Таковы, например, следующие функции распределения:
1) равномерная: r(Q) = A;
2) линейная: r(Q) = bQ + const;
3) показательная: r(Q) = g Q n ;
4) экспоненциальная: r(Q) = a e – m Q ,
где A, b, g, n, a, m – некоторые постоянные.
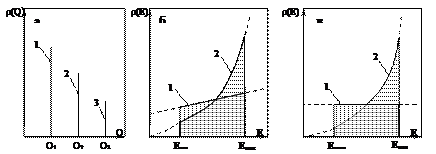
На рис. 19 показаны графики функций распределения для различных случаев. Для однородной поверхности теплота адсорбции (и энергия активации) постоянна для всех участков; на графике функция распределения изобразится острым пиком (рис. 19, а). Для непрерывных распределений график будет представлять некоторую кривую; площадь, заключенная между ней и ординатами Q1 и Q2, как показано на рис. 20, то есть площадь ABQ2Q1 дает числовое значение доли адсорбционных центров, на которых адсорбция идет с теплотой от Q1 до Q2 .
Поскольку функция распределения выражает долю поверхности, обладающую данным свойством в определенных пределах значений, она по своему смыслу должна быть нормирована
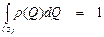 или
или 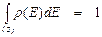 , (13)
, (13)
то есть интеграл от функции распределения по всем значениям данного свойства, которыми обладает рассматриваемая поверхность, взятый по всей поверхности, должен быть равен единице.
Введение функции распределения позволяет найти аналитический вид различных функциональных соотношений для поверхности катализатора или адсорбента. Для конкретного расчета, конечно, необходимо знать вид функции r(Q) или r(Е).
|
| Рис. 19. Различные типы функции распределения r(Q) и r(Е): а – дискретная функция распределения, отдельный пик (1, 2 или 3) соответствует однородной поверхности; б – линейная (1) и показательная (2); в – равномерная (1) и экспоненциальная (2) |

| Рис. 20. Доля адсорбционных центров со значением теплот адсорбции от Q1 до Q2 на графике зависимости r(Q) от Q |
Взаимодействие молекул в адсорбционном слое
Первым толчком к развитию теории процессов на неоднородных поверхностях явилось обнаружение понижения теплот адсорбции по мере роста заполнения поверхности. Однако неоднородность поверхности по теплотам адсорбции может возникнуть в ходе самого адсорбционного процесса в результате взаимодействия между адсорбирующимися молекулами и поверхностными атомами твердого тела.
Молекулы в адсорбционном слое отталкиваются друг от друга. Отталкивание молекул приведет к тому, что теплота адсорбции будет уже не постоянна в ходе процесса, а явится функцией заполнения поверхности
Q(s) = Qо [1 – j(s)], (14)
где j – потенциал адсорбционного центра. Поскольку с увеличением заполнения теплота адсорбции падает, имеем
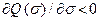 , (15)
, (15)
откуда
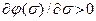 . (16)
. (16)
Подставляя в уравнение Ленгмюра (11) значение Q(s) из (14), получим изотерму адсорбции с учетом взаимодействия молекул в адсорбционном слое
 . (17)
. (17)
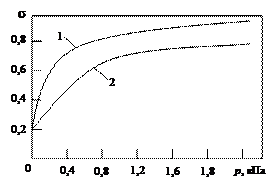
| Рис. 21. Изотермы адсорбции при отсутствии (1) и наличии (2) взаимодействия в адсорбционном слое |
При малых заполнениях поверхности членом j(s) в выражении (17) можно пренебречь, и уравнение совпадает с уравнением ленгмюровской изотермы. При больших заполнениях (то есть при больших равновесных давлениях р) уже нельзя пренебречь снижением адсорбционного потенциала, и равновесное заполнение поверхности будет медленнее расти с ростом давления, чем это должно было бы происходить при отсутствии взаимодействия (рис. 21).
Отталкивание между адсорбированными молекулами должно сказаться также и на кинетике десорбции. В случае ленгмюровской адсорбции кинетика десорбции должна подчиняться уравнению первого порядка
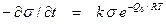 . (18)
. (18)
Энергия активации десорбции тоже не должна изменяться в ходе процесса. Между тем при наличии сил отталкивания в адсорбционном слое, кинетика подчиняется уравнению
 , (19)
, (19)
приводящему к кинетическому порядку выше первого. Энергия активации в этом случае растет по мере уменьшения степени заполнения поверхности.
Таким образом, основные закономерности адсорбции на неоднородных поверхностях могут быть объяснены энергетической неравноценностью адсорбционных мест и взаимодействием адсорбированных молекул между собой и молекулами или атомами сорбента. В одних случаях преобладает влияние неоднородности поверхности и влиянием взаимодействия сорбированных молекул можно пренебречь, в других случаях существенно взаимодействие сорбированных молекул.
Лекция 44
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!