
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон парциальных давлений Дальтона
|
|
|
|
Газовые законы
Закон Авогадро.
Атомные массы, молекулярные массы и моли.
Атомная масса – масса атома, выраженная в атомных единицах массы (а.е.м.). За единицу атомной массы принято считать 1/12 массы атома углерода (изотопа С12). mC. Значения атомных масс приведены в таблице Д.И. Менделеева.
Молекулярная масса – масса молекулы, выраженная в а.е.м.
Молекулярные массы определяются путем суммирования атомных масс, входящих в их состав атомов.
Например:
М (N2) = M (N) + M (N) = 14 + 14 = 28.
Важнейшим понятием, используемым во всех химических расчетах, является моль. Моль любого вещества представляет такое его количество, в котором число структурных единиц этого вещества (молекул, атомов, ионов) равно числу атомов в 12 г изотопа углерода 12.
Таким образом, моль вещества – это такое его количество в граммах, которое численно равно его молекулярной массе, выраженное в атомных единицах массы. Число частиц в моле называется числом Авогадро
NA = 6.02 1023 (частиц моль-1)
Масса 1 моль вещества называется молярной массой (М, г/моль).
В развитии атомистической теории чрезвычайно важную роль сыграла гипотеза, предложенная Авогадро в 1811 г. Он предположил, что при одинаковых температуре и давлении в равных объёмах всех газов, содержится равное число молекул. Это означает, что плотность газа должна быть пропорциональна его молекулярной массе.
Если принять гипотезу Авогадро, то число молекул газа, а следовательно, и число n его молей должно быть пропорционально объёму газа:
Число молей газа n = k V (P,T = const)
В этом уравнении k – коэффициент пропорциональности, зависящий от температуры и давления k = f (T, P)
Слово ²газ² происходит от хорошо известного греческого слова ²хаос². Химики гораздо позже подошли к изучению газов, чем других веществ. Углекислый газ открыли в 1756 г, водород 1766, азот 1772. Несмотря на столь позднее открытие газов, они явились первыми веществами, физические свойства которых удалось объяснить при помощи простых законов.
утверждает, что каждый компонент газовой смеси ведёт себя в ней таким образом, как будто других компонентов не существует. Давление, создаваемое одним компонентом газовой смеси, называется его парциальным давлением.
Т.о, суммарное давление Р газовой смеси представляет собой сумму парциальных давлений компонентов этой смеси, каждый из которых может рассматриваться так будто, он является единственным газом, имеющимся в заданном объеме å Pi = Робщ.
Закон Дальтона или парциальных давлений в общем виде Pi = Xi Pобщ
Где, Xi- мольная доля i-го компонента смеси веществ, которое определяется как отношение число молей ni данного вещества i к суммарному числу молей всех веществ этой смеси:
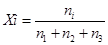
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!