
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Развитие представлений о строении атома
|
|
|
|
Лекция 3. СТРОЕНИЕ АТОМА
Первая частица, которая должна входить в состав атома, была открыта Дж. Томсоном в 1897 г и названа электроном. После открытия электрона Томсон стал искать его место в атоме. Дж. Томсон в 1906 г предложил первую модель атома, в которой атом представляет собой твердый шар из положительно заряженного вещества, в который вкраплены отрицательно заряженные электроны. В результате потери электронов под действием света или электрического поля нейтральный атом превращается в положительно заряженный катион, а после присоединения лишних электронов – в отрицательно заряженный анион. Однако эта модель не могла объяснить большую устойчивость такого конгломерата противоположно заряженных частиц.
В 1910 г Эрнст Резерфорд опроверг модель Томсона. Из экспериментов с рассеянием альфа-частиц вырисовывалась такая картина строения атома: в центре его находится чрезвычайно плотное, положительно заряженное ядро, которое окружено отрицательными зарядами – электронами. Для того, чтобы электрон не упал на ядро, он должен с большой скоростью вращаться вокруг ядра. Такая модель по аналогии с Солнечной системой была названа планетарной. Ядро и электрон заряжены, а потому по законам электродинамики, они должны были испускать электромагнитное излучение, терять энергию, и в конце концов электрон должен был бы упасть на ядро, чего не происходит. Это противоречие планетарной модели не было преодолено вплоть до появления квантовой теории.
В 1900 г немецкий физик Макс Планк впервые ввёл в науку понятие квант. Энергия электромагнитного излучения выделяется порциями или квантами. Энергия одного кванта излучения пропорционально частоте излучения
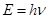 ,
,
где h – постоянная Планка, h=6.6262 10-34 Дж×с.
Великий немецкий физик А. Эйнштнейн в 1905 г применил теорию Планка к объяснению фотоэлектрического эффекта, который возникал только при определённой частоте света независимо от его интенсивности.
Датскому физику Нильсу Бору в 1913 г удалось теоретически рассчитать значение постоянной Ридберга т.е. спектр водорода. Но этого ему удалось достичь только путем принятия нескольких постулатов, противоречащих классической физике XIX в. Основной постулат Бора гласил, что электрон может вращаться не по любым орбитам, а лишь по дозволенным, удовлетворяющим требованию квантования его углового момента:

где n – целочисленное квантовое; h=h/2p; m, v и r – масса, линейная скорость и радиус орбиты электрона в атоме соответственно. В соответствии со вторым постулатом Бора атом поглощает или излучает энергию при взаимных переходах с одной орбиты (n1) на другую (n2). Теория атома водорода, предложенная Бором имела существенный недостаток: она позволяла объяснить свойства атома водорода и других водородоподобных атомов, состоящих из ядра с одним электроном.
Согласно современным представлениям, атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов: массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов.
После открытия М. Планком и А. Эйнштейном квантования энергии физики вплотную столкнулись с проблемой корпускулярно-волнового дуализма. С одной стороны, свет обладает свойствами волны: имеет определённую частоту, длину волны, изменяет плоскость колебаний и т.д. С другой стороны, свет оказывает давление, вызывает фотоэлектрический эффект (пример фотоэффекта – датчики в турникетах метро), наконец, его энергия изменяется не непрерывно, а дискретно.
Важнейшим принципом квантовой механики является принцип неопредёленности, установленный немецким физиком В. Гейзенбергом в 1927 г. Согласно этому принципу, невозможно одновременно определить положение и импульс любой частицы с абсолютной точностью. Произведение неопределённостей нахождения координаты х и импульса mvx должно быть не менее ħ
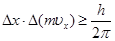
Принцип неопределённости связан с тем, что сам акт измерения вносит изменение в энергию, импульс и координату измеряемого объекта. Мы определяем пространственное расположение предметов, окружающих нас, улавливая специальными клетками нашего организма, рецепторами глаз, отражённый от материального тела поток фотонов. Именно фотон в данном случае является средством измерения. Фотон в процессе соударения с объектом сообщает ему некоторую энергию. Разумеется, поток фотонов не в состоянии подвинуть грузовик, стоящий за окном в институтском дворе или изменить направление движения любого другого макроскопического тела, но в микромире, например, для случая соударения фотона с электроном, изменяется как частота и направление движение первого, так и координата второго. Ситуация в микромире напоминает гипотетический спортивный зал, где один из игроков решил измерить координату другого, запустив в него мячом для медицинбола.
В 1924 г французский физик Луи де Бройль выдвинул гипотезу: не только излучение обладает корпускулярными свойствами, но и материальные частицы обладают волновыми. Совместное рассмотрение этого уравнения с первым постулатом Бора приводит к формуле де Бройля для длины волны
 ,
,
где m - масса электрона, скорость и длина волны.
Далее он предположил, что это уравнение имеет универсальный характер, т.е. что с каждой частицей связана волна, а с каждой волной – частица.
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы, поэтому для описания его поведения нельзя пользоваться привычными характеристиками, такими как скорость и траектория движения. Вместо этого используют полную энергию электрона (сумма потенциальной и кинетической энергии) и вероятность обнаружения электрона в заданной области пространства.
В 1926 г австрийский физик Эрвин Шрёдингер предложил уравнение, описывающее энергетическое состояние электрона в поле атомного ядра.
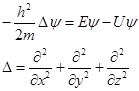
где D– оператор Лапласа, Е – полная, U – потенциальная энергия, m – масса электрона, ψ – волновая функция, описывающая вероятность нахождения электрона в данной точке пространства в окрестностях атомного ядра.
Уравнение Шрёдингера имеет решения только при некоторых определённых значениях энергии электрона. Решения уравнения показывают вероятности нахождения электрона в той или иной точке пространства. При решении уравнения Шрёдингера получается полная характеристика электрона в атоме.
Состояние электрона в атоме характеризуется волновой функцией, являющейся решением волнового уравнения Шрёдингера. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества орбитального движения и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным – n, орбитальным – l, магнитным - m l. Четвёртое квантовое число - m s, называют спиновым. Волновая функция при определённых значениях трёх квантовых чисел (n, l,m l) описывает состояние электрона характеризующееся так называемой атомной орбиталью (АО).
Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность т.е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака. Уравнение Шрёдингера описывает нахождение электрона в трёхмерном пространстве, в соответствии с этим существуют три квантовых числа, характеризующие энергетическое состояние единичного электрона в поле ядра и форму распределения плотности его заряда в атоме.
Главное квантовое число n определяет энергию АО и номер энергетического уровня, на котором находится электрон и может принимать значения от единицы до бесконечности.
Орбитальное квантовое число 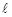 определяет форму АО и энергетический подуровень и может принимать значения от нуля до n-
определяет форму АО и энергетический подуровень и может принимать значения от нуля до n-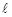 .
.
Магнитное квантовое число m l определяет пространственную ориентацию данной АО и отчасти её форму и может принимать значения от – 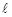 …0…+
…0…+ 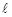 .
.
В многоэлектронном атоме оказывается существенным собственный магнитный момент электрона (в планетарной модели Бора-Резерфорда он связан с наличием собственного момента количества движения у электрона – "шарика", вращающегося не только по орбите вокруг ядра, но и вокруг собственной оси, (по-английски spin - волчок), который также квантуется.
Спиновое квантовое число ms характеризует собственный магнитный момент электрона, и может принимать значения ± 1/2.
Общий магнитный момент (спин) атома определяется как сумма собственных магнитных моментов (спинов) всех электронов. Порядок заполнения внешней оболочки многоэлектронного атома определяется правилом Хунда: При заполнении внешней оболочки многоэлектронного атома внешняя АО заполняется таким образом, чтобы абсолютное значение спина атома был максимальным.
Число АО в пределах энергетического подуровня определяется числовым значением магнитного квантового числа (2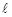 +1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
+1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
Последовательность распределения электронов в атоме по мере увеличения значений 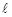 и n выражается электронными или электронно-графическими формулами. В первом случае энергетические уровни обозначают цифрами, а подуровни – буквами с верхним индексом указывающим число электронов. Во втором случае атомные орбитали условно обозначают квантовыми ячейкам, а электроны векторами, что даёт возможность показать различие в ориентации их спинов: и ¯.
и n выражается электронными или электронно-графическими формулами. В первом случае энергетические уровни обозначают цифрами, а подуровни – буквами с верхним индексом указывающим число электронов. Во втором случае атомные орбитали условно обозначают квантовыми ячейкам, а электроны векторами, что даёт возможность показать различие в ориентации их спинов: и ¯.
Так строение атома фтора выражается электронной формулой 1s22s22p5 и электронно-графической формулой:
2s 2p
| 1s | ¯ | ¯ | ¯ | | ||
| ¯ | ||||||
При заполнении АО действует принцип Паули, из которого следует, что в атоме не может быть двух электронов, характеризующихся тождественным набором значений всех четырёх квантовых чисел. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа.
Принцип Паули определяет ёмкость (максимальное число электронов) энергетических уровней и подуровней, которая соответственно равна 2n2 и 2(2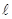 +1) т.е. удвоенному числу АО.
+1) т.е. удвоенному числу АО.
В соответствии с правилом Хунда, заполнение энергетических подуровней происходит таким образом, чтобы модуль суммарного спина всех электронов подуровня (и, соответственно, всего атома) был максимальным. Например, четыре валентных p – электрона атома кислорода размещаются в квантовых ячейках следующим образом:
2p
| ¯ | | |
Закономерная последовательность заполнения энергетических уровней и подуровней в атомах с увеличением порядкового номера элемента выражается правилом Клечковкого, которое называют правилом суммы n+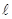 . Согласно этому правилу порядок заполнения определяется возрастанием этой суммы, а при одинаковом её значении первым заполняется подуровень с меньшим значением n в этой сумме:
. Согласно этому правилу порядок заполнения определяется возрастанием этой суммы, а при одинаковом её значении первым заполняется подуровень с меньшим значением n в этой сумме:
1 s ® 2 s ® 2 p ® 3 s ® 3 p ® 4 s ® 3 d ® 4 p ® 5 s ®
4 d ® 5 p ® 6 s ® …
Правило Клечковского позволяет заранее предвидеть появление в периодической системе Д.И. Менделеева рядов из d -, а затем из f - элементов, которые вклиниваются между s – и p – элементами больших периодов.
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: s- элементы – заполнение внешнего s - подуровня при наличии на предвнешним уровне двух или восьми электронов, например:
Li 1s2 2s2
р- элементы – заполнение внешнего p- подуровня, например:
F 1s2 2s2 2p5
d- элементы – заполнение предвнешнего d- подуровня, например:
V 1s22s22p63s23p64s2 3d3
f- элементы – заполнение f- подуровня второго снаружи уровня, например:
 Nd 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
Nd 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома (получении ими порции энергии) становится возможным «разъединение» валентных электронов, то есть их переходы с тех подуровней, где все АО заняты полностью (¯) или частично (¯) на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбуждённых состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов). Например, валентными электронами атома осмия в основном состоянии являются следующее: 5d6 6s2. Их распределение по квантовым ячейкам:
5d 6s
| ¯ | | | | | ¯ |
(атом осмия находится в 4–валентном состоянии).
При этом как на пятом, так и на шестом уровнях имеются вакантные АО. Получение атомом осмия двух последовательных порций энергии приводит к следующим возбуждённым состояниям: Os*
5d 5f 6s
| | | | | | | ¯ |
(атом осмия находится в шести валентном состоянии;
Os**
5d 5f 6s 6p
| | | | | | | | |
(атом осмия находится в 8 – валентном состоянии).
В соответствии с современными представлениями об электронном строении атомов, Периодический закон в настоящее время формулируется следующим образом:
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 571; Нарушение авторских прав?; Мы поможем в написании вашей работы!