
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изотопы
|
|
|
|
Изотопы
Итак, к началу ХХ века химия практически сформировалась как систематическая научная дисциплина. На прочном фундаменте основных законов химии, и, прежде всего, закона сохранения массы и энергии, законе постоянства состава, законов весовых и объёмных отношений были получены необходимые данные, на основании которых Д.И. Менделеев в России открыл Периодический закон (и на год позже, не зная о работе Д.И. Менделеева, практически это же сделал Ю.Л. Майер в Германии). В первое десятилетие ХХ века Э. Резерфорд и Н. Бор создают модель атома. Эта модель ещё несовершенна, и не объясняет всех наблюдаемых закономерностей, но это - проблемы именно физиков и химики до поры до времени данным кругом вопросов не интересовались. Химики, как тогда казалось, могли спокойно предаваться экспериментам на своём традиционном поприще, выполнять рутинные анализы, например, определять состав горных пород, но не тут то было…
Как мы уже отмечали, для соединений, называемых дальтонидами, весовое соотношение одного из действующих веществ или продуктов химического превращения ко всякому другому является постоянным (закон постоянства состава Пруста) и вплоть до 1914 г химики считали непреложным фактом, что в хлориде свинца PbCl2 содержится свинец и хлор в соотношении 207,2: 2●35,46. Однако, проф. Ричасрдс из Гарвардского университета нашёл, что из свинца, содержащегося в урановой руде, получается PbCl2, в котором на то же самое число частей хлора приходится от 206,1до 206,8 частей свинца. Хоннингшмидт и Горовиц нашли, что в некоторых случаях свинец из того же самого источника входит в соединение в количествах ещё меньших, а именно, 206, 05 и 206,06, но спектрально этот свинец оказался тождественным обычному свинцу. Свинец, исследованный Ричардсом, однако, имел несколько меньшую плотность: 11,288 вместо 11,337. Английский учёный Содди, нашёл, что свинец, извлечённый из ториевой руды, даёт PbCl2 с более высоким содержанием свинца, чем это бывает при исследовании обычной свинцовой руды, а именно, 208,4: 2●35,46.
Современникам ничего не оставалось, как сделать парадоксальный вывод о существовании трёх хлоридов свинца, обладающих одними и теми же свойствами и представляющими собой одно и то же вещество, но различающимися по составу.
Сегодня мы без труда можем объяснить этот факт, поставивший в тупик химиков в 1914 году. Как мы уже знаем, ядро атомов состоит из протонов и нейтронов, причём, число протонов определяет заряд ядра, и, соответственно, строение электронной оболочки атома, и, как следствие, его химическую природу. А вот количество нейтронов в атоме одного и того же химического элемента может различаться.
Так, водород представляет собой смесь атомов трёх разновидностей. Одна из них, подавляющая обилием своих атомов, имеет ядра, не содержащие ни одного нейтрона. Эту разновидность водорода называют протием, и обозначают формулой [р+]е- или 1Н. Более тяжёлые атомы, ядра которых содержат по одному протону и одному нейтрону, в своей совокупности составляют разновидность водорода, называемую дейтерием, эту разновидность обозначают следующим образом: [р+n]e- или 2Н или D.
Третья разновидность, именуемая тритием, встречается наиболее редко и состоит из атомов, заключающих в своём ядре по два нейтрона и одному протону: [р+nn]e- или 3Н или Т. Тритий радиоактивен, то есть, неустойчив, его атомы способны самопроизвольно превращаться в атомы особой разновидности гелия, или как его называют, лёгкого гелия. Сперва происходит самопроизвольное превращение ядра трития в ядро лёгкого гелия.
[р+nn]e- = [р+р+n]e- +ß-+ν^
При этом один из ядерных нейтронов превращается в протон, порождая одновременно антинейтрино и быстролетящий электрон или ß –частицу, покидающую атом. Образованная в результате первой стадии радиоактивного превращения частица [р+р+n]e- не является нейтральной, так как в её ядре два протона, а в электронной оболочек лишь один электрон. присоединив к себе извне второй электрон, указанная частица превратится в нейтральный атом 3Не.
[р+р+n]e- + е- = = [р+р+n]e-е-
Три разновидности водорода относятся к одному и тому же номеру в ряду элементов, то есть занимают в нём одно и то же место. Поэтому их называют изотопами водорода. Слово изотоп по-русски означает «равноместный». Совокупность изотопов данного элемента называется его изотопной плеядой. Исследования показали, что все элементы, подобно, водороду имеют несколько разновидностей атомов; в плеяде каждого элемента имеются неустойчивые, радиоактивные разновидности атомов с самопроизвольно превращающимися ядрами. Устойчивыми изотопами обладает большинство элементов, но не все, имеются элементы, изотопные плеяды которых совсем не имеют устойчивых атомов, например, технеций Тс (41), прометий Рm (61), радий, торий, уран и т.д. Общее количество стабильных атомных разновидностей, приходящихся на известные сейчас элементы, достигает 275,.
Распространение устойчивых изотопов между элементами таково:
| число устойчивых изотопов | |||||||||||
| число элементов, отвечающих данному числу изотопов | >21 |
Элементы, имеющие по одной устойчивой разновидности многочисленны, их – 26 элементов: Be4, F9, Na11, Al13, P15, Sc21, Mn25, Co27, As33, Rb37, Y39, Nb41, Rh45, In49, J53, Cs55, La57, Pr59, Tb65, Ho67, Tm69, Lu71, Ta73, Re75, Au79,Bi83. Как видно из списка, все эти элементы, за исключением Be4, имеют нечётные порядковые номера (периссиады). Элементов, состоящих из смеси двух устойчивых разновидностей – семнадцать: H1, He2, Li3, B5, C6, N7, Cl17, K19, V23, Cu29, Ga31, Br35, Ag47, Sb51, Eu63, Ir77, Te81. Как видно из списка, все они, за исключением Нe2 и C6, также периссиады.
Все элементы, имеющие более сложные плеяды изотопов, являются артиадами, то есть имеют чётные порядковые номера. К их числу принадлежат
5 элементов, имеющих по три устойчивых изотопа:
O, Ne, Mg, Si, Ar;
:6 элементов, с четырьмя изотопами
S, G?, fe, Sr, Ce, Pb
6 элементов с пятиизотопными плеядами
Tu, Ni, Zn, Ge, Zr, W;
8 элементов, имеющих 6 устойчивых изотопов:
Ca, Se, Kr, Pd, Sm, Er, Hf, Pt;
9 элементов, имеющих по 7 изотопов:
Mo, Ru, Ba, Nd, Gd, Dy, Yb, Os, Hf;
2 элемента с 8 изотопами Cd, Te;
9 устойчивых изотопов имеет Xe
10 устойчивых изотопов у олова. Sn
Наиболее сложные по своему изотопному составу артиады: элементы, находящиеся в средней части системы, так например,
| элемент | Sn | Xe | Cd | Te | Mo | Ru | Ba | Nd | Gd | Dy | Yb | Os | Hg |
| № | |||||||||||||
| число изотопов |
Все элементы имеют не только стабильные, но и радиоактивные разновидности атомов, значительную их часть приходится приготовлять искусственно. Неустойчивые разновидности, имеющие достаточно длительные периоды существования атомов и присутствующие на земной поверхности в значительных количествах, играют значительную роль на Земле.
| Изотоп | период полураспада Т1/2, лет | Содержание изотопа |
| 14С | 10-14 в природном углероде живых существ | |
| 40К | 1,4●109 | 0,012% от всего К в земной коре |
| 87Rb | 6,2●1010 | 27,85 от всего в Rb земной коре |
| 147Sm | 6,7●1011 | 15,07% от всего Sm в земной коре |
| 115In | 6●1014 | 95,77% от всего In в земной коре |
В плеядах элементов не имеющих ни одного стабильного изотопа имеются ядра с большим периодом полураспада, определяющие своим присутствием свойства элемента. Периоды полураспада соответствующих изотопов таковы:
238U 4,5●109 лет
232Th 1,4●1010 лет
226Ra 1622 года
224Pu 7,6●107 лет
Физические и химические свойства изотопов весьма близки, их сравнительное содержание в природных смесях остаётся постоянным, что говорит о глубинных природных (энергетических и структурных) закономерностях их генезиса.
Наибольшее отличие свойств изотопов одного и того же элемента наблюдается в случае водорода, так как масса его атомов отличается в два-три раза. Например, температуры кипения водорода различного изотопного состава оказываются следующие:
| Состав молекулы | Н2 | HD | D2 | HT | DT | T2 |
| Ткип.ОK | 20,4 | 22,4 | 23,6 | 23,6 | 24,3 | 24,9 |
Различные изотопные разновидности (по водороду) воды имеют следующие константы:
| Вода | Н2О | D2О | T2О |
| Ткип.ОС | +3,81 | +4,49 | |
| Тпл. ОС | +100 | +101,431 |
Для изотопов других элементов эти различия не столь резкие, и разделение изотопов, например, урана является весьма непростой технологической задачей.
Лекция 4. Химическая связь и строение молекул.
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кристаллах, характеризуемый определенной энергией. При всем многообразии химических связей их природа едина и носит электростатический характер.
Механизм образования химической связи может быть смоделирован различными способами. Простейшим является метод валентных связей (ВС), предложенный Льюисом.
Метод валентных связей рассматривает химическую связь как результат притяжения ядер двух атомов к одной или нескольким общим для них электронным парам. Такая двух электронная и двух центровая связь, локализованная между двумя атомами, называется ковалентной.
Принципиально возможны два механизма образования ковалентной связи:
1. спаривание электронов двух атомов при условии противоположной ориентации их спинов;
2. донорно-акцепторное взаимодействие, при котором общей становится готовая электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора).
Причиной образования любого типа химической связи является понижение энергии системы, которая сопровождает этот процесс. Разность энергии начального и конечного состояния системы называется энергией связи (Есв) и определяется количеством теплоты, выделяющейся при её образовании. Энергия ковалентных химических связей оценивается значениями порядка 125-1050 кДж/моль.
Расстояние между ядрами двух связанных атомов называется длиной связи. Длина и энергия связи зависят от её кратности, которая определяется числом электронных пар, связывающих два взаимодействующих атома. Чем кратность связи выше, тем больше энергия связи и меньше длина.
Ковалентную связь характеризуют насыщаемость, направленность и полярность.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определённого числа связей, которое обычно лежит в пределах: от 1 до 6. Общее число валентных орбиталей в атоме определяет максимально возможную ковалентность элемента. Число уже использованных для этого орбиталей определяет ковалентность элемента в данном соединении.
Если атом образует все связи только за счёт спаривания электронов, то обычно говорят просто о его валентности, которая определяется числом неспаренных электронов в основном или возбуждённом состояниях.
Если атом образует связи по обменному и донорно-акцепторному механизмам, то говорят о ковалентности.
В таком случае валентность бора в молекуле BF3 равна трём, а в комплексном ионе BF4 – ковалентность равна четырем.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счёт возможно большей электронной плотности между ядрами взаимодействующих атомов. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s- электронные орбитали, поскольку они имеют сферическую форму. Перекрывание орбиталей может осуществляться различным образом: s, p, d- способами. При образовании s- связи возникает одна область перекрывания орбиталей, симметричная относительно линии, соединяющей ядра – межъядерной оси.
После образования между двумя атомами s- связи для остальных электронных орбиталей той же формы и с тем же главным квантовым числом остаётся только возможность бокового перекрывания по разные стороны от линии связи, перпендикулярно которой в этом случае проходит узловая плоскость. В результате образуются p- или d- связи. В первом случае возникают две, во втором – четыре области перекрывания.
Число s- связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа.
Связи, образованные атомом за счёт орбиталей с различным значением орбитального квантового числа, должны быть энергетически неравноценными, что, однако, не подтверждается экспериментом. В подобных случаях пользуются представлением о гибридизации орбиталей (Л. Полинг), согласно которым при образовании связи орбитали разной симметрии смешиваются и превращаются в гибридные орбитали одинаковой формы и усредненной энергии, что обеспечивает равноценность образуемых ими связей. В гибридизации могут участвовать не только одноэлектронные, но так же двухэлектронные атомные орбитали. В этом случае, на гибридных орбиталях остаётся такое же число неподеленных электронных пар, которое было на исходных атомных орбиталях.
Геометрическая конфигурация молекул полностью определяется типом гибридизации орбиталей центрального атома только при условии, что все гибридные атомные орбитали участвуют в образовании связей. Если же хотя бы на одной из них остаётся неподеленная электронная пара, то конфигурация, определяемая типом гибридизации не реализуется.
Метод валентных связей позволяет объяснить полярность ковалентной связи. Если электроотрицательность атомов, образующих молекулу, одинакова или очень близка, то общая электронная пара располагается симметрично по отношению к обоим ядрам. Такая ковалентная связь называется неполярной (гомоядерные молекулы).
Если электроотрицательность атомов различная, то электронная пара смещается в сторону более электроотрицательного атома. В этом случае центры (+) и (-) зарядов не совпадают, и возникает система (электрический диполь) из двух равных по величине, но противоположных по знаку зарядов (d+ и d-), расстояние между которыми (l) называют длиной диполя. Подобные ковалентные связи называют полярными. Степень полярности такой связи оценивается значением электрического момента диполя- m, равного произведению эффективного заряда на длину диполя
m=q· l.
Наконец, если разница электроотрицательностей (Dc) превышает 1,9, то образуется ионная связь – предельный случай ковалентной полярной связи. Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами.
Ионная связь, в отличие от ковалентной, является ненаправленной, ненасыщенной, а координационные числа в ионных соединениях определяются соотношением радиусов взаимодействующих ионов.
Вторым способом объяснения ковалентной химической связи является метод молекулярных орбиталей. В этом случае химическая связь рассматривается как результат распределения электронов в молекуле по соответствующим молекулярным орбиталям, которые находят в наиболее простом приближении методом линейной комбинации атомных орбиталей. Из n-го числа атомных орбиталей образуется n-ое число молекулярных орбиталей.
Перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей, одна из которых имеет более низкую, а другая более высокую энергию, чем первоначальные атомные орбитали. Соответственно эти молекулярные орбитали называют связывающей и разрыхляющей. Заполнение молекулярных орбиталей происходит так же как и атомных, т.е. в соответствии с принципом Паули и правилом Хунда.
Водородной называют связь образуемую атомом водорода, который ковалентно связан с атомом сильно электроотрицательного элемента А и другим подобным атомом В:
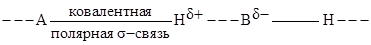
Чем выше электроотрицательность атомов А и В, тем больше эффективные заряды 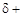 на атоме Н и
на атоме Н и 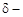 на атоме В, а следовательно, тем сильнее между ними электростатическое взаимодействие и прочнее водородная связь.
на атоме В, а следовательно, тем сильнее между ними электростатическое взаимодействие и прочнее водородная связь.
Силы взаимодействия между молекулами, которые называют ван-дер-ваальсовыми или межмолекулярными, обусловлены тремя видами взаимодействия: ориентационное, индукционное и дисперсионное. С ростом относительных молярных масс силы межмолекулярного взаимодействия возрастают и, как следствие, повышаются температуры плавления и кипения веществ.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 998; Нарушение авторских прав?; Мы поможем в написании вашей работы!