
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы для самопроверки. 1. Геосферы. 2. Геосинклиналь
|
|
|
|
Ключевые слова
1. Геосферы. 2. Геосинклиналь. 3. Платформа. 4. Геохронологическая шкала. 5. Живые организмы.
1. Что и на каком языке означает слово Земля?
2. В чем состоит коренное отличие Земли от других планет Солнечной системы?
3. Какую форму имеет Земля и каковы ее размеры?
4. Какая из геосфер Земли имеет наибольшую массу?
5. Как проявляется тепловое поле Земли и как изменяется температура в недрах с глубиной?
6. В чем состоит отличие земной коры на материках и под океанами?
7. Какие оболочки Земли граничат с земной корой?
8. Какая из внутренних оболочек Земли доступна для непосредственного изучения?
9. Как называются обширные подвижные участки земной коры, в пределах которых возникают горные массивы?
10. В чем состоит отличие древних и молодых платформ?
11. Из каких крупных структурных элементов состоят платформы?
12. Каков химический состав атмосферы?
13. Что служит главным источником энергии ветра?
14. Что понимается под абсолютной отметкой рельефа?
15. Какие компоненты образуют географическую оболочку Земли?
16. Как называется этап геологической истории до появления скелетных организмов?
17. В какой период геологической истории организмы появились на суше?
18. Каковы современные представления о появления жизни на Земле?
19. В чем состоят главные отличия живых организмов от неживых объектов?
3. ВЕЩЕСТВЕННЫЙ СОСТАВ НЕДР. МИНЕРАЛЫ И ГОРНЫЕ ПОРОДЫ
Геохимическая классификация элементов. Из внутренних геосфер Земли для изучения и практического использования доступна лишь верхняя часть земной коры. Средние содержания химических элементов в земной коре, гидросфере, Земле в целом, космических телах и др. геохимических системах оценивают в кларках (в честь амер. геохимика Ф.У. Кларка). Различают весовые (мас. %; г/т) и атомные (в % от числа атомов) кларки. В земной коре преобладают восемь элементов: кислород (46÷47), кремний (25,7÷27,7), алюминий (7,7÷8,1), железо (5,0÷6,2), кальций (3,6÷5,8), магний (2,1÷3,2), натрий (1,8÷2,8) и калий (1,3÷2,6), (∑99 мас.%) (Ti 0,4; H, P, Mn по 0,1 мас.%). На долю кислорода приходится почти половина массы земной коры и с учетом ионного радиуса, кислород занимает порядка 60% ее объема. Земную кору можно представить как соединения кислорода и кремния c примесью других элементов и соединений.
Распространенность химических элементов это своеобразное отражение стабильности ядер их атомов в земной коре. Наиболее распространены элементы с четными порядковыми номерами в периодической таблице (табл. 1). Содержание химических элементов, в общем, убывает по мере увеличения массовых чисел ядер атомов и часто не соответствует обыденным представлениям. Так кларки широко используемых элементов Cu, Zn, Pb во много раз меньше, чем кларки считающихся редкими Zr, V, Y. Причина этого в различной способности элементов к образованию в земной коре устойчивых соединений в значительных концентрациях.
Химические элементы, имеющие близкие химические и физические свойства, обусловленные в значительной степени строением внешних электронных оболочек, концентрируются в определённых геохимических системах и делятся на четыре группы: литофильные, халькофильные, сидерофильные, атмофильные. Один и тот же химический элемент может концентрироваться в разных природных системах.
Литофильные (камнелюбивые) элементы – основные химические элементы горных пород, проявляют химическое сродство к кислороду. В их число входят 54 элемента периодической системы: О, Si, Al, С, все щелочные и щёлочноземельные металлы, галогены и многие редкие элементы. Большинство из литофильных элементов в свободном состоянии не встречается. На литофильные элементы приходится около 97 мас.% солей вод океанов — продуктов разрушения (выветривания) горных пород.
Халькофильные (меделюбивые) элементы - основные химические элементы сульфидных руд (S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po). Халькофильные металлы обладают сродством к S, Se, Te, часть из них встречается в свободном состоянии. В определённых условиях благодаря способности накапливаться образуют месторождения сульфидных руд.
Сидерофильные (железолюбивые) элементы - группа переходных химических элементов, относящихся в основном к VIII группе периодической системы (Fe, Со, Ni, Ru, Rh, Pd, Os, Ir, Pt) и некоторые другие элементы (Mo, Re); иногда к сидерофильным элементам относят также Au, Р, As, С, Ge, Ga, Sn, Sb. В земной коре сидерофильные элементы встречаются либо в самородном состоянии (металлы группы платины - МПГ) либо в соединениях низших валентностей. Сидерофильные элементы обнаруживают химическое сродство к мышьяку (арсениды Pt, Со, Ni, Fe), несколько меньше — к сере (главным образом Mo и Re, а также Pd, Fe, Со, Ru, Pt). Сидерофильные элементы за исключением Fe характеризуются очень низкими кларками. Металлы группы платины обладают пониженной миграционной способностью.
Атмофильные элементы - химические элементы типичные для атмосферы Земли. За исключением водорода и углерода в атмосфере они находятся в виде простых веществ. К атмофильным элементам относят: водород, азот и инертные газы (гелий, неон, аргон, криптон, ксенон и радон). Кислород, слагающий ~47 мас.% литосферы, принадлежит к литофильным элементам.
Особую группу образуют биофильные элементы – так называемые элементы жизни, входящие в состав живого вещества. Они делятся на макробиогенные (H, C, N, O, Cl, Br, S, P, Na, K, Mg, Ca) и микробиогенные (V, Mn, Fe, Co, Cu, Zn, B, Si, Mo, F).
Минералы. Минералы – это продукты природных химических процессов, свойственных геосферам Земли. Чаще всего под минералом (от лат. minera – руда) подразумевают природное элементарное геологическое тело, обладающее индивидуальными физическими и химическими свойствами, состоящее из одного, либо из закономерного сочетания химических элементов.
Минерал – частная форма сонахождения химических элементов. Минерал - промежуточное звено в ряду объектов разной категории сложности. Элементарные частицы образуют атомы; атомы, соединяясь химическими связями, образуют минеральные индивиды; ассоциации минералов слагают горные породы; горные породы формируют определенные структурно-вещественные комплексы (геологические формации), в совокупности образующие земную кору. К минеральным образованиям относят природные неорганические соединения, соли органических кислот и углеводородные ископаемые смолы (янтарь)[62].
Термин минерал применяется как по отношению к конкретным кристаллам и зернам - минеральным индивидам, так и к их определенным группам – минеральным видам, выделяемым по составу или структуре. Минеральные виды по отличиям в форме, свойствах, составе или атомарной структуре (кристаллической решетке) разделяют на разновидности. Идентичные по химическому составу минералы с разной структурой и соответственно имеющие другой облик и иные свойства, относят к разным минеральным видам, например, алмаз, графит и фуллерен (С); кальцит и арагонит (CaCO3); пирит и марказит (FeS2). Это явление называется полиморфизмом.
В кристаллических решетках минералов химические элементы могут замещаться другими, если их заряды совпадают по знаку, близки по атомным весам, а ионные радиусы различаются менее чем на 25%, при этом соединения различные по составу кристаллизуются в одинаковых формах. Это явление носит название изоморфизм. Так, например, железо в минералах может быть замещено или замещает Al, Ti, V, Cr, Mn, Co, Ni, Zn, Ga, In, Pt; медь может быть замещена или замещает Co, Ni, Zn, Ga, Ag, Pt, Au, Hg, Tl, Pb, Bi. Поэтому большинство химических формул минералов носит качественный характер, указывает только главные (видообразующие) элементы и их примерное соотношение.
К началу XIX века было известно менее 100 минеральных видов, к концу XIX в. – 1500, в настоящее время число известных минеральных видов приближается к 4000, хотя 85 химических элемента могут дать порядка 1028 сочетаний. Из-за незначительной распространенности большинства химических элементов и рамок природных условий число минералов ограничено. Минеральные виды, открываемые в последнее время, чаще всего представлены отдельными зернами, примазками, пленками.
В технике и промышленности используют порядка 600 минералов. Практическая ценность минералов определяется возможностью извлечения из них химических элементов или их особыми свойствами (твердостью, тугоплавкостью, электроизоляционными, оптическими, декоративными, пьезоэлектрическими и др.). Порядка 40 минералов могут применяться в естественном виде без разделения на химические элементы (как консервант, абразивы, молекулярные сита, драгоценные и поделочные камни, огнеупоры). Минералы слагают руды, используются как флюсы и горно-химическое сырье. Примерно 25 минералов могут образоваться в живых организмах, это главным образом, фосфаты, оксалаты, карбонаты, сульфаты, кремнезем, оксиды и гидроксиды железа.
Минералы чаще всего встречаются в виде минеральных зерен и при благоприятных условиях принимают форму кристалла.[63] Традиционно считается, что кристалл – твёрдое тело,[64] имеющее естественную форму правильного многогранника, обусловленную периодичным расположением атомов[65] (ионов) в узлах структурного каркаса (рис. 4).
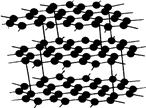
Рис. 4. Кристаллическая решётка графита
Кристаллическая решетка возникает как следствие размещения ионов с учетом сил их притяжения и отталкивания наиболее плотно друг к другу, при условии трёхмерной периодичности. Электронные оболочки атомов, объединённых в кристаллическую решетку химическими связями, перекрываются. Это позволяет рассматривать структурную решетку как непрерывное периодическое распределение отрицательных зарядов атомов, с максимумами около дискретно расположенных ядер.
Кристалл – система равновесная в конкретных физико-химических условиях. Атомы в кристаллической решетке, колеблются около положений равновесия, причём характер колебаний зависит от координации атомов, энергии связи и внешних условий. С повышением температуры колебания атомов усиливаются, что может привести к разрушению структурной решетки и переходу вещества в жидкое состояние или. Кристаллическое вещество всегда анизотропно, т. е. оценки физико- механических свойств по непараллельным направлениям различны.
Каждому химическому соединению, находящемуся в кристаллическом состоянии при заданных термодинамических условиях, соответствует определённая кристаллическая структура, определяющая его внешнюю форму и анизотропию физических свойств. Упорядоченность пространственного расположения атомов в кристаллической решетке минерала выражается через симметрию. Симметрия кристаллов – закономерная повторяемость в пространстве его геометрических элементов.
Форма кристаллов воспринимается через элементы их огранения – грани, ребра и вершины. Грани кристаллов, как правило, параллельны плоским сеткам пространственной решетки с наиболее плотным расположением атомов, сила сцепления между этими плоскостями минимальна. Грани пресекаются по прямым линиям – ребрам. Ребра кристаллов параллельны рядам ионов с наиболее сильной химической связью в решетке. Точки пересечения ребер образуют вершины. Форма и размеры кристаллов варьируют, но все кристаллы конкретного минерала имеют одну и ту же симметрию.
Элементы симметрии связаны воображаемыми плоскостями и линиями (осями) симметрии, которые могут проходить через общую точку (центр симметрии). Оси симметрии (L) – поворотные оси, при вращении вокруг которых на определенный (элементарный) угол тождественные части кристалла повторяются[66]. Плоскость симметрии (Р) – плоскость отражения тождественных частей кристалла. Центром симметрии (С) является особая точка внутри кристалла, характеризующаяся тем, что любая прямая проходящая через нее на равных расстояниях по обе стороны от центра встретит структурно тождественные точки кристалла. Сочетание элементов симметрии в кристаллах подчиняется определенным правилам, ограничивающим возможные комбинации элементов симметрии. Существует 32 класса симметрии, каждому из которых отвечает определенная кристаллографическая формула, указывающая конкретные элементы симметрии в соответствующих пространственных формах. Например, кристаллы кубической формы имеют 3 четверные, 4 тройные, 6 двойных осей, 9 плоскостей и центр симметрии (формула симметрии 3L44L36L29PC); прямоугольный параллелепипед - 3L23PC; шар – бесчисленное множество осей симметрии бесконечного порядка, бесконечное множество плоскостей и центр симметрии (кристаллографическая формула ∞L∞∞РС).
Зависимость между внутренним строением и внешней формой кристаллов выражена в основном законе кристаллографии – законе постоянства углов[67], согласно которому, углы между соответственными гранями и ребрами во всех кристаллах минерала одного вида постоянны.
По огранению кристаллы делятся на две группы: т.н. простые формы, состоящие из одинаковых по форме и величине симметрично расположенных граней (куб, октаэдр) и комбинаций 47 простых форм. В природе может быть 7 основных видов кристаллических конструкций, каждой из которых соответствует определенное число плоскостей, осей определенного порядка и центр симметрии.
Форма реальных кристаллов обычно отличается от идеальной. Условия зарождения и роста кристалла влияют на его облик. При обильном поступлении исходных веществ возникают несовершенные кристаллы содержащие посторонние включения. При недостатке соответствующего минерального вещества в питающих растворах кристалл начинает растворяться. Облик кристалла во многом зависит от его положения во время роста. Например, если кристалл кварца во время формирования свисает вертикально, то сила тяжести направлена вдоль длинной оси кристалла (L3), а питающие растворы поступают медленно и равномерно, при этом формируются наиболее совершенные кристаллы с чистыми блестящими гранями. При росте снизу вверх грани кристалла кварца оказываются загрязненными. При наклонном или горизонтальном положении длинной оси кристалла, питающие растворы обтекают его неравномерно, нижние грани получают меньше питания, чем обращенные кверху. Если исходное вещество осаждается преимущественно на ребрах кристаллов, то грани начинают отставать в скорости роста и при этом возникают ажурные («скелетные») кристаллы (снежинки). Минеральное вещество может заполнить весь ограниченный объем произвольной формы, образуя при этом не кристаллы, а зерна. Размеры кристаллических зерен меняются от 1 нм (коллоидно-дисперсные минералы) до 15 м (кристаллы кварца, берилла, полевого шпата, мусковита).
Вследствие изменений условийроста, захвата примесей и вторичной деформации в кристаллах возникают точечные дефекты и нарушается порядок упаковки атомных слоев. При наличии в минерале всего 10-7% примесных атомов число дефектов в 1 см3 кристаллической решетки составит примерно 1013.[68] Природныекристаллы всегда состоят из разно ориентированных кристаллических блоков размером 10-4÷10-6 см, структура каждого изкоторых почти идеальна. Физические свойства кристаллов существенно зависят от типа и количества дефектов. Нарушения в кристаллической решетке обуславливают возможность диффузии[69] – важнейшего процесса в недрах.
Искажение формы кристаллов подчиняется четким закономерностям и происходит только в пределах допускаемых их симметрией. Кристаллы при росте сохраняют только те элементы симметрии, которые являются общими и для кристалла и для кристаллообразующей среды. Кристаллы обладают «памятью»: изучение дефектов кристаллов позволяет восстановить условия их формирования.
Часто в природе наблюдаются псевдоморфозы – минеральные образования, облик которых не соответствует их составу и строению. Псевдоморфозы возникают при замещении исходного вещества минеральным веществом иного состава с сохранением исходной формы. Например, псевдоморфоза халцедона по древесине, гетита по пириту, магнетита по гематиту (мушкетовит) и пр.
Физические свойства кристаллов определяются их составом, структурой и преобладающим типом связи, составляющих их атомов (ионов)[70]. В большинстве минералов химические связи имеют смешанный характер.
Кристаллы изучают рентгеноструктурным, электронoграфическим и др. методами, что позволяет определить размеры элементарной ячейки и структуру кристаллов.
Ряд минеральных образований имеет аморфное строение (опал, обсидиан, янтарь, твердые нафтиды) с беспорядочным расположением составляющих его атомов (молекул) и изотропностью (физические свойства одинаковы во всех направлениях). Аморфные и высокодисперсные вещества относят к минералоидам.
Кристаллическое состояние вещества более устойчиво, чем аморфное, т. к. закономерному расположению иона в структурной решетке отвечает минимальная внутренняя энергия. В процессе свободного роста кристаллические образования стремятся принять форму характерную именно для данного вещества (самоограниться[71]). Аморфные вещества не способны к самоогранению.
Упрощенная диагностика минералов основывается на оценке облика зерен (кристаллов) и их агрегатов; физических свойств (показатель преломления, цвет, блеск, спайность, твердость, ковкость, хрупкость, плотность, магнитность, радиоактивность, плавкость и др.)[72] и химических особенностей (реакции с кислотами, основаниями, горючесть и др.), органолептических свойств. Для точной диагностики минералов используют оптико-микроскопические, термические, рентгеноспектральные и др. методы.
Минеральные индивиды могут иметь изометрический, уплощенный или удлиненный вид. Часто минералы встречаются в виде закономерных сростков одиночных кристаллов – двойников, своеобразных «роз», «щеток» (друз)[73] (рис. 5), зерен. Грани некоторых кристаллов имеют штриховку, возникающую в связи с особенностями роста.
 Рис. 5. Друза кристаллов кварца (БСЭ)
Рис. 5. Друза кристаллов кварца (БСЭ)
По способности пропускать свет (по величине показателя поглощения света) минералы делятся на: прозрачные, полупрозрачные, просвечивающие и непрозрачные. Многие минералы просвечивают в тонких осколках и шлифах[74]. Агрегаты, состоящие из различно ориентированных зерен прозрачного минерала, непрозрачны, так как свет многократно преломляясь в разных направлениях, рассеивается и отражается.
При прохождении света через прозрачный кристалл может наблюдаться его расщепление на два пучка, распространяющихся с разными скоростями в двух взаимно перпендикулярных плоскостях. Это явление называется двойным лучепреломлением и является диагностическим свойством, например, для разновидности минерала кальцита - исландского шпата.
Блеск минералов – светоотражение, определяется показателями преломления и поглощения света, а также характером отражающей поверхности. Различают минералы с металлическим, металловидным и неметаллическим блеском. Блеск, напоминающий блеск полированного металла называют металлическим, потускневшего металла металловидный (полуметаллический). Наиболее яркий блеск - металлический характерен для минералов с металлическим типом химической связи: самородных металлов (золото, серебро, медь и др.), многих сульфидных соединений (галенит, пирит и др.) и окислов металлов (магнетит, пиролюзит и др.). Неметаллический блеск характерен для прозрачных минералов. В порядке убывания яркости различают следующие виды неметаллического блеска: алмазный - характерен для минералов с ковалентным типом химической связи (алмаз, касситерит и др.), стеклянный - характерен для минералов с ионно-ковалентным типом химической связи (кварц, гипс, кальцит и др.), перламутровый (слюда, гипс и др.), шелковистый (асбест и др.), жирный (самородная сера и др.). У некоторых минералов блеск на гранях кристаллов и на изломе различный. Так, например, у кварца на гранях блеск стеклянный, а на изломе жирный. Плёнки и налёты на поверхности резко изменяют блеск минералов.
Цвет минералов – способность поглощать свет (электромагнитные волны) определяется химическим составом и типом химической связи атомов и ионов, а также дефектами и примесями в составе минерала. Избирательное поглощение обуславливает цвет минерала в узком диапазоне спектра. Если поглощение света равномерно по всему диапазону спектра минерал окрашен в серые цвета (от белого до черного).
При описании цвета кристаллов (минеральных зерен) часто сопоставляют его с цветом каких-либо предметов или веществ (яблочно-зелёный, лимонно-жёлтый, кроваво-красный и т.п.) или минеральных «цветовых эталонов» (киноварно-красный, изумрудно-зелёный и др.). Эталонами для характеристики цвета рудных минералов служат цвета металлов или сплавов — оловянно-белый (арсенопирит), стально-серый (молибденит), латунно-жёлтый (халькопирит), медно-красный (самородная медь) и т. д. Многие минералы обладают свойством менять свой цвет по различным кристаллографическим направлениям (плеохроизм) или в зависимости от характеристик источника света.
Окраска минералов может быть: идиохроматической (собственной) если обусловлена их химическим составом (видообразующими или примесными элементами, играющими роль хромофоров), особенностями кристаллической структуры; аллохроматической, вызванной механическими примесями, чаще всего включениями окрашенных минералов, иногда — пузырьками жидкостей, газов и т. п.[75] Псевдохроматическая окраска обусловлена дифракцией и интерференцией света, а также рассеянием, преломлением, полным внутренним отражением белого света, особенностями строения минеральных образований (закономерным чередованием фаз различного состава в иризирующих лабрадорах, солнечном и лунном камнях; глобулярным строением опалов и т.п.) или состоянием поверхностного слоя минеральных зерен (побежалости — радужные плёнки на халькопирите, пирите и др.).
Цвет драгоценных и поделочных камней является одной из основных характеристик их качества. Различают цвет минералов в кристаллах (зернах) и агрегатах, под микроскопом (в шлифах и аншлифах[76]), в тонком порошке (цвет черты).
Цвет черты является более выдержанным диагностическим признаком, чем окраска минерала в зерне. Цвет порошка минерала и окраска минерала в зерне часто не совпадают. Цвет черты может зависеть от размерности частиц порошка минерала. Например, серая черта молибденита при растирании зеленеет, а серая черта антимонита буреет.
Спайность – свойство минералов раскалываться по определенным кристаллографическим направлениям с образованием поверхностей различной степени совершенства (ровности и блеска). По степени совершенства различают следующие виды спайности: весьма совершенную (слюда), совершенную и среднюю (полевые шпаты и др.), несовершенную (апатит, касситерит и др.), весьма несовершенную (золото, кварц и др.). Спайность в минералах может проявляться по одному или нескольким направлениям. В одном кристалле из-за особенностей его симметрии и типа структуры может проявиться несколько видов спайности. Поверхности спайности в совокупности образуют многогранники, имеющие характерный облик кристаллов данного минерала. Двугранные углы между плоскостями спайности являются одним из диагностических признаков.
Минералы могут раскалываться также и по произвольным поверхностям - изломам, в совокупности образуя отдельности. Различают изломы занозистые (опал), раковистые (кварц), шестоватые (хризотил-асбест) и др. Ковкие самородные металлы (медь, серебро, золото и др.) дают крючковатые изломы.
Твердость – степень сопротивления механическому воздействию. Наибольшей твердостью обладают минералы с плотным расположением атомов (ионов) в кристаллической решетке, в случае их ковалентной связи и высокой валентности. Присутствие в кристаллической структуре гидроксильных групп или молекул воды снижает твёрдость минералов. Кроме этого твердость минералов зависит от количества и состава примесей, газово-жидких микровключений, дефектов в структуре, степени выветрелости минерала и т. д. По относительной твердости минералы разделяются на 10 групп. Типичные представители (эталоны) каждой группы составляют т. н. минералогическую шкалу твердости, предложенную Ф. Моосом в 1811 г. (от 1 до 10 в порядке возрастания: тальк, гипс, кальцит, флюорит, апатит, ортоклаз, кварц, топаз, корунд, алмаз). Относительная твёрдость определяется путём царапанья испытываемой поверхности эталоном. Часто твердость определяют более просто. Минералы с твердостью 1 и 2 царапаются ногтем, 3 медной проволокой, 4 гвоздем, 5 стеклом, 6 напильником. Минералы с твердостью 6 и больше царапают стекло. По абсолютной твердости алмаз (10060 кг/мм2) превосходит кварц (1130 кг/мм2) в 9 раз, а тальк (2,4 кг/мм2) в 4200 раз.
По плотности минералы делятся на легкие до 2,5 (например, минеральные соли), средние 2,5÷4 (например, кварц) и тяжелые более 4 (например, барит).
Химические свойства (например, реакции с кислотами и основаниями, горючесть) и различная растворимость в воде, также помогают диагностировать минералы. Например, значительная часть карбонатов выделяет углекислый газ при реакции с разбавленной соляной кислотой в нормальных условиях; сера горит; халькопирит окисляется на воздухе; минеральные соли легко растворяются в воде и т. д.
Минералы можно различать и по органолептическим свойствам (вкусу и запаху), а также по характерному облику. Например, арсенопирит при ударе издает «чесночный» запах, кварц запах «горелого рога»; галит соленый на вкус, сильвин горько-соленый.
Ряд минералов радиоактивен (уранинит, урановая смолка). Свойства минералов, подвергшихся радиоактивному воздействию, могут существенно измениться (метамитизация).
Перечисленные свойства и признаки минералов характеризуют условия их образования и особенности минералообразующей среды и называются типоморфными. Типоморфные характеристики минералов используют при оценке перспективности участка недр на выявление залежей полезных ископаемых.
Часто в природе отмечается связь конкретных минералов между собой по месту и условиям образования (парагенезис минералов). В этом случае наличие одного минерала позволяет предположить возможность выявления другого (например, пирит и халькопирит; галенит и сфалерит). Наряду с парагенезисом минералов большое практическое значение имеет и запрещенный парагенезис (невозможность одновременного образования и сонахождения) конкретных минералов (например, кварца и нефелина; минералов возникающих только в приповерхностных условиях с минералами больших глубин).
Химический состав минералов и их структурная организация являются важнейшими характеристиками, от которых зависят их физические свойства. По химическому составу (часто ведущему аниону) и строению минералы объединяются в типы[77], важнейшими из которых являются: самородные элементы, сульфиды, оксиды и гидроксиды, галоиды, карбонаты, сульфаты, фосфаты, силикаты, алюмосиликаты.
Самородные элементы (простые вещества) – состоят из атомов лишь одного химического элемента, встречаются в природе в виде более или менее устойчивых минералов. На самородные элементы приходится менее 0,02% от массы земной коры. Среди самородных элементов различают: неметаллы (полиморфные модификации углерода — алмаз, графит и др.; самородные S, Se, Te), полуметаллы (самородные As, Sb) и металлы (самородные Au, Ag, Сu, Pt, Pd, Ir, Os, Fe, Ta, Pb, Zn, Sn, Hg, Bi). К типу простых веществ относят тесно связанные с ними генетически твёрдые растворы простых веществ и интерметаллические соединения, например, минералы ферроплатина; электрум (AgAu) и т.д. Самородные элементы иногда образуют промышленно значимые скопления - месторождения.
Сульфиды (сернистые соединения) - класс минералов, по химическому составу представляющих собой соединения металлов с серой. На сульфиды приходится порядка 0,5% от массы земной коры. По типу химической связи сульфиды — преимущественно ковалентные соединения. Главными видообразующими элементами сульфидов являются Fe, Pb, Cu, Sb, As, Co, Ni, входящие в состав многих десятков минеральных видов. Менее разнообразны соединения Zn, Cd, Mo, Hg. К элементам, встречающимся в виде изоморфных примесей в сульфидах, относятся Au, Ag, Ga, Ge, In, Tl, Re и др. Большинство сульфидов непрозрачны, часто имеют высокую отражательную способность. Твёрдость по минералогической шкале обычно 2÷4, у слоистых сульфидов от 1÷2 (молибденит и др.) до 5÷7 (пирит и др.). Плотность свыше 4. При окислении на поверхности Земли сульфиды переходят в сульфаты, а затем в гидроксиды, карбонаты и др. соли кислородных кислот, реже в самородные элементы (например, Cu, Ag). Многие сульфиды являются важными рудными минералами. Важнейшие диагностические свойства 10 наиболее распространенных сульфидов приведены в таблице.
Таблица
Свойства наиболее распространенных сульфидов
| Блеск | |||||
| металлический | неметаллический | ||||
| Относительная твердость | |||||
| >5 | <5 | ||||
| Цвет минеральных зерен | |||||
| серый | желтый | серый | желтый | бурый | красный |
| Арсенопирит - FeAsS | Пирит - FeS2 (кубики) | Галенит – PbS (кубики) | Пентландит - (Fe,Ni)9S8 (спайность) | Сфалерит (ZnS) | Киноварь (HgS) |
| Молибденит -(MoS2) | Пирротин - FeS | ||||
| Антимонит – Sb2S3 (лучистый) | Халькопирит -CuFeS2 |
Оксиды и гидроксиды - группа минералов, представляющих собой химические соединения элементов с кислородом и/или с гидроксильной группой. На минералы этой группы приходится порядка 17% массы земной коры, причем на долю минералов кремнезема 12,6%, а оксиды и гидроксиды железа составляют 3÷4% от массы земной коры. В качестве катионов в составе оксидов и гидроксидов встречено до 40 элементов; главные из них относятся к литофильным (Si, Ti, Nb, Ta, Mn, Al, Mg, Sn, Zr и др.) и в меньшей степени к халькофильным и сидерофильным элементам. Среди оксидов выделяют простые оксиды (например, минералы кремнезема - SiO2, корунд - Al2O3, гематит - Fe2O3, касситерит - SnO2) и сложные оксиды, состоящие из одного или двух атомов металла с различной валентностью и кислорода (магнетит - FeO×Fe2O3, хромит FeCr2O4). Многие оксиды и гидроксиды являются ценными рудными и нерудными полезными ископаемыми (например, окисные руды Mn, Fe, Al и др.). Важнейшие диагностические свойства 11 наиболее распространенных оксидов и гидроксидов приведены в таблице.
Галоиды - класс минералов, по химическому составу представляющие собой соли галогеноводородных кислот. Наиболее распространены в природе хлориды, реже фториды, бромиды и иодиды весьма редки, а астатиды вообще не встречаются.
Таблица
Свойства наиболее распространенных оксидов и гидроксидов
| Облик | |||
| кристаллы, зернистые агрегаты | натеки, плотные и землистые агрегаты | ||
| Черта | |||
| нет, слабая | окрашенная | нет, слабая | окрашенная |
| Кварц | Магнетит | Халцедон | Гетит[78] |
| Хромит | Гематит | Опал | Пиролюзит |
| Касситерит | Бокситы[79] | ||
| Корунд |
По составу, свойствам и условиям образования природные хлоридыделятся на две группы. К первой группе относятся растворимые в воде хлориды Na, К, NH4, Mg, Ca, Al, Mn и Fe. Наиболее распространенные минералы: галит (NaCl), сильвин (KCl), бишофит (MgCl2×6H2O), карналлит (KMgCl3×6H2O) и др. Содержат 20÷70% Cl. В основе кристаллических структур лежит кубическая упаковка атомов Cl. Химические связи в основном ионные. Часто бесцветны; твердость 1÷2, плотность 1,6÷3,2. Гигроскопичны, хорошо растворяются в воде, частично в спирте; на вкус солёные или горькие. Слагают зернистые и плотные массы в крупных месторождениях, прожилки и желваки в осадочных толщах; друзы, налёты и корочки в осадках озёр, солончаках и продуктах вулканической деятельности.
Ко второй группе относят нерастворимые в воде хлориды Cu, Pb, Ag, Hg, As, Sb и Bi, часто с анионами О-, OH-; иногда с [NO3]-, Fe-, [SO4]2. Содержат 6÷35% Cl. Химическая связь в основном ковалентная. Цвет минералов бесцветный, синий, зелёный, жёлтый. Образуют корочки, друзы, налёты, землистые массы. Твердость по минералогической шкале до 4, плотность 3,7÷8,3. Образуются в зоне окисления рудных месторождений в условиях сухого климата при воздействии солёных вод на рудные минералы, а также в процессе вулканической деятельности. Многие хлориды используются в химической и пищевой промышленности, сельском хозяйстве.
В природе фтор чаще соединяется с Na, К, Ca, Mg, Al и с редкоземельными элементами (TR), реже с Cs, Sr, Pb, Bi, В. Фториды бесцветны или окрашены в различные цвета, прозрачные или просвечивающие, со стеклянным блеском, твёрдостью 2÷5, плотностью 2,0÷3,2 и низкими показателями преломления (1,30÷1,50). Фториды возникают в возгонах вулканов, иногда встречаются в гранитах и их эффузивных аналогах, щелочных породах. Наиболее распространён в природе флюорит (CaF2). Кроме флюорита, практическое значение имеет криолит (Na3[AlF6]). Месторождения редки.
Карбонаты – группа широко распространённых природных соединений угольной кислоты (H2CO3) с литофильными (Na, Ca, Mg, Sr, Ba, TR), а также халькофильными (Zn, Сu, Pb, Bi) элементами. В состав карбонатов входят один или два главных катиона с добавочными анионами или без них. Основой структуры карбонатов является анион [СО3]2-, у которого углерод находится в тройной координации по отношению к атомам кислорода. Группы [СО3]2- соединяются через катионы или дополнительные анионы (OH)-, F-, Cl-. Карбонаты имеют твёрдость от 3 до 5, повышенную растворимость в воде, лёгкую растворимость в соляной кислоте, высокое двойное лучепреломление; диссоциируют при нагреве. Цвет карбонатов зависит от ионов-хромофоров. Карбонаты меди — зелёные и синие, урана — жёлтые, железа и редких земель — коричневые, кобальта и марганца — розовые, остальные бесцветны или слабо окрашены.
Карбонаты образуются в морских бассейнах (карбонаты кальция и магния слагают мощные толщи известняков частью биогенного происхождения и доломитов), в гидротермальных рудных месторождениях (кальцит, сидерит, анкерит), в коре выветривания (магнезит), в зоне окисления сульфидных руд (малахит, азурит). Карбонаты слагают горные породы (например, известняк) Многие карбонаты (например, смитсонит, малахит, церуссит, стронцианит, сидерит и др.) могут использоваться как руды Zn, РЬ, Bi, Ba, Sr, Cu, Fe, Мn, TR и др. металлов, как сырьё для цементной и химической промышленности (например, кальцит известняка, магнезит) и как строительный и поделочный материал (доломит, малахит). На карбонаты приходится порядка 1,5% массы земной коры (преобладает кальцит - CaСО3).
Фосфаты – группа природных соединений ортофосфорной кислоты (H3PO4) с катионами [Са2 +, Fe2 +, Fe3 +, Al3 +, (UO2)2 +, Cu2 +, Mn2 +, Pb2 +, Zn2 + и др.], добавочными анионами (OH-, Cl-, F-, O2-, CO32-) или молекулярной водой. Редко в их состав входят и кислотные радикалы ([SiO4]2-, [SO4]2-, [ВО3]3- и др).
В основе структурной решетки фосфатов лежат изолированные тетраэдры [РO4]3-, связанные между собой солеобразующими катионами. Фосфаты встречаются в виде массивных зернистых агрегатов, землистых масс, оолитов (конкреций)[80], корочек, реже кристаллов. Окраска разнообразная. Твердость от 2 до 6; плотность 1,7÷7,1.
Фосфаты образуются в основном в верхней части земной коры – на дне морей, озёр, в болотах, почвах и корах выветривания; в зоне окисления рудных месторождений. Известны фосфаты и магматического происхождения (апатит связан со щелочными породами; монацит с пегматитами и гранитами); ряд фосфатов встречается в виде примесей в жилах. На фосфаты приходится порядка 0,7% массы земной коры. Фосфаты в основном рассеяны. Наиболее распространены и практически важны минералы группы апатита (Ca5(PO4)3(F,Cl,OH)) (скрытокристаллический апатит слагает фосфориты), вивианит ((Fe2 +,Fe3 +)[РО4]×8Н2О), монацит, бирюза и др.
Фосфаты используются в качестве сырья для получения фосфора и удобрений. Вивианит – дешёвая синяя краска и удобрение, монацит – источник редких земель и тория, бирюза – ювелирное сырье.
Сульфаты - класс минералов, представляющих собой соли серной кислоты, большинство из которых не устойчивы и редки. Важнейшие видообразующие катионы сульфатов: Fe (особенно Fe3+), Na+, К+, Cu2+, Mg2+, Al3+, Ca2+, Pb2+, Ва2+. Основная кристаллохимическая структурная единица сульфатов — тетраэдр [SO4]2-, в котором сера находится в центре. Кристаллы сульфатов, как правило, имеют изометрический облик. Цвет сульфатов обусловлен ионами-хромофорами, минеральными включениями и наличием дефектов. Плотность сульфатов от 1,5 до 6,9. Для сульфатов характерна низкая твёрдость (2÷3,5), растворимость в воде.
Сульфаты образуются в зоне гипергенеза (выветривания) и при седиментогенезе[81] в крупных водных бассейнах (например, гипс – CaSO4×2H2O); в ходе гидротермальных процессов (барит – BaSO4 и др.); в зоне окисления сульфидных месторождений и при деятельности вулканов.
Сульфаты находят применение как руды металлов (Ва, Sr, Pb и др.), в химической, резиновой, бумажной, лакокрасочной, сахарной, фармацевтической, кожевенной, текстильной и др. отраслях промышленности; в стекольном и керамическом производстве; при бурении — как утяжелитель глинистых растворов (барит); в строительном деле для изготовления связующих (гипс и ангидрит - CaSO4). На сульфаты приходится порядка 0,1% массы земной коры.
Силикаты и алюмосиликаты – природные химические соединения с комплексным кремнекислородным радикалом, образуют сопряженные классы наиболее распространённых минералов, в том числе важнейшие породообразующие — полевые шпаты, пироксены, амфиболы, слюды и др. На силикаты и алюмосиликаты приходится 25% от общего числа минералов. Слагают более 75% земной коры по массе[82], а вместе с кварцем около 87% и более 95% массы изверженных горных пород.
В основе структур всех силикатов лежит кремнекислородный радикал [SiO4]4- в форме тетраэдра. Важной особенностью силикатов является способность к сочетанию (полимеризации) кремнекислородных тетраэдров через общий атом кислорода. Силикаты различаются по химическому составу, наличию воды или гидроксильной группы и дополнительных анионных групп. По характеру сочетания кремнекислородных тетраэдров выделяется 5 подклассов силикатов: островные, кольцевые, цепочечные, слоистые, каркасные. Минералы, в структуре которых тетраэдрические алюмокислородные радикалы [AlO4]5-частично замещают радикал [SiO4]4-, выделяют в тип алюмосиликатов. Из-за сложного строения большинство силикатов имеет низкую симметрию: около 45% кристаллизуется в моноклинных и лишь 9% в изометрических формах.
Для силикатов характерно двойникование[83] и изоморфизм. Вследствие этого силикаты часто образуют твёрдые растворы, а также изоморфные примеси. Из-за большой сложности формулы силикатов являются условными. Распределение изоморфных составляющих в структуре силикатов зависит от температуры при образовании. Это позволяет использовать силикаты в качестве геотермометра.
Спайность силикатов определяется, прежде всего, характером сочетаний кремнекислородных тетраэдров (несовершенная в островных и кольцевых силикатов, совершенная и зависящая от ориентировки кремнекислородных группировок в цепочечных, слоистых и каркасных силикатах); твёрдость обычно 5,5÷7, кроме слоистых силикатов, у которых она понижается до 2÷1; плотность 2,5÷3,5. Цвет большинства силикатов определяется ионами железа (Fe2+ — зелёный, Fe3+ — бурый, красный, жёлтый, Fe2+ и Fe3+ - синий и др.), Ti3+, V4+, Cr3+, Mn2+, Co2+, Ni2+, Cu2+ и др. У некоторых силикатов окраска аллохроматическая.
Силикаты возникают при кристаллизации магмы, в ходе метаморфических, метасоматических и гидротермальных процессов, а также при выветривании. Очень крупные кристаллы силикатов образуются в пегматитах. Полагают, что оливин и др. плотные силикаты преобладают в верхней мантии Земли.
При выветривании силикатов выщелачиваются основные соединения, освобождается кремнезём, образуются глинистые минералы[84], а также окислы железа, карбонаты и др.
Силикаты (плагиоклазы, оливин, пироксены и др.) являются главными породообразующими минералами, входят в состав метеоритов и лунных пород. Ряд силикатов имеют значение как руды лития, бериллия, никеля, рассеянных элементов. Например, нефелин - комплексное сырьё для получения алюминия, поташа, соды. Большую долю нерудных полезных ископаемых (полевые шпаты, слюды, асбест, тальк, цеолиты, бентонитовые и огнеупорные глины), драгоценных и поделочных камней (изумруд, аквамарин, топаз, хризолит, турмалин, гранаты и др.) составляют силикаты.
Основные диагностические свойства и практическое значение отдельных минералов приведены в приложении 2.
Горные породы. Горные породы - природные агрегаты минералов или органического вещества, образующие геологические тела, слагающие литосферу Земли, твердые оболочки планет земной группы и Луны. Науки, изучающие горные породы – петрография, литология, петрофизика.
Горные породы могут состоять как из одного, так и из нескольких минералов и в отличие от минералов более неоднородны. Из общего числа минералов лишь 150 являются породообразующими, причем главными следует считать всего 10. До 60 минералов слагают 99% горных пород. Самыми распространенными минералами земной коры (~60 мас. %) являются полевые шпаты. Минералы, доля которых по объему в горной породе не превышает 2%, называются акцессорными. В природе сочетания минералов определяются физико-химическими процессами породообразования и геохимическими законами распространения литофильных химических элементов. Валовой химический состав горных пород характеризуется массовой долей наиболее распространенных (главных) оксидов: SiO2, Al2O3, Fe2O3, FeO, CaO, MgO, Na2O, K2O, H2O и Р2O5.
Состав, строение, свойства, состояние и условия залегания горных пород определяются ходом геологических процессов, приводящих к их образованию и изменению. Различают три генетических класса горных пород: осадочные, магматические и метаморфические, а также переходные группы пород. Магматические и метаморфические горные породы слагают соответственно примерно 50 и 40% объема земной коры, осадочные менее 10% (занимая около 75% поверхности Земли).
Горные породы различаются не только составом, но и особенностями строения, включающими понятия структура и текстура. Структура и текстура наряду с минеральным составом являются важнейшими диагностическими признаками горных пород.
Структура горных пород– характеристика, отражающая генезис и преобразования горных пород, выраженные через размер и форму минеральных зерен. Для магматических и метаморфических горных пород структуры определяются степенью кристаллизации (полно-, неполно- и скрытокристаллическая, стекловатая и др.), размерами (крупно-, средне- и мелкозернистая), а также формой зерен, способом сочетания их между собой и с нераскристаллизованной массой. Структуры осадочных горных пород зависят от состава первичного осадка, динамики среды осадконакопления, величины и формы минеральных частиц, взаимного расположения, соотношения и особенностей физических связей между ними. Примеры наименований структур осадочных горных пород: тонко-, мелко-, средне- и крупнозернистые; рыхлые и сцементированные.
Текстурагорных пород – характеристика упорядоченности в расположении минеральных зерен в породе. Примеры названий текстур горных пород: массивная (неупорядоченная), слоистая (полосчатая), флюидальная, пористая.
Горные породы при кондиционном (промышленно значимом) содержании полезных компонентов или непосредственно (без выделения минеральных составляющих) могут быть использованы в качестве полезного ископаемого. Горные породы следует рассматривать как объекты разработок и как конструктивные элементы горных выработок.
Как физические тела горные породы характеризуются прочностными, плотностными, упругими, тепловыми, магнитными, электрическими, радиационными и др. свойствами, обусловленными их составом, строением и термодинамическими условиями формирования и нахождения. Например, теплоемкость, коэффициент теплового расширения, модуль объемного сжатия горных пород зависят от минерального состава пород, а прочность, упругость, тепло и электропроводность и от строения. Механические свойства обусловлены силами связей минеральных зерен, а тепловые и электрические – их ориентировкой и наличием проводящих каналов в горных породах.
Межминеральные связи в горных породах осуществляются за счет поверхностной и объемной сил[85]. Природа поверхностных сил состоит в следующем. Атомы в кристаллической решетке минерала химически связаны. В поверхностном слое минерального зерна силы межатомного взаимодействия с внешней стороны не компенсированы, вследствие этого поверхностные слои обладают избыточной энергией. Часть этой энергии идет на образование межминеральных связей. Степень проявления поверхностной энергии прямо пропорциональна удельной поверхности зерен и обратно пропорциональна расстоянию между ними.
Свойства горных пород зависят также от электрического, магнитного, радиационного воздействия и насыщения пород жидкостями, газами и т.д. Изменение одного из свойств горной породы приводит к изменению ряда других. Так увеличение пористости приводит к снижению плотности, прочностных и упругих свойств, теплопроводности, диэлектрической проницаемости, а также к увеличению влагоемкости и водопроницаемости горных пород.
Совокупность химических, физико-механических, водных и горно-технологических свойств горных пород и их взаимосвязь определяют технологию горных работ и бурения скважин, переработки (использования) полезных ископаемых, меры по управлению состоянием массива горных пород, особенности конструкций оснований и фундаментов сооружений при строительстве.
Магматические (изверженные) горные породы - естественные ассоциации минеральных зерен и вулканического стекла[86] в разных пропорциях. Магматические породы, образовавшиеся в условиях высоких температур и давлений из существенно силикатного расплава – магмы, относятся к группе ортопород, а возникшие в процессе метасоматоза[87] к группе парапород.
Главные породообразующие минералы магматических горных пород - силикаты и алюмосиликаты (полевые шпаты, слюды, пироксены, амфиболы), часто кварц и др. Содержание главных оксидов в магматических породах меняется в широких пределах (SiO2 24÷80 мас.%, Al2O3 0÷20 мас.%, Fe2O3 0÷13 мас.%, FeO 0÷15 мас.%, CaO 0÷17 мас.%, MgO 0÷30 мас.%, Na2O 0÷14 мас.%, K2O 0÷13 мас.%, H2O 0÷3 мас.%). По содержанию кремнезема по массе магматические горные породы делят на группы: кислые (SiO2 более 64%), средние (SiO2 53÷64%), основные (SiO2 44÷53%), и ультраосновные (менее 44% SiO2). При содержании кремнезема более 53% в магматической горной породе присутствует свободный кварц. В кислых породах содержание кварца превышает 10% по объему. Содержание кремнезема коррелирует с количеством цветных (темных) минералов и плотностью породы. Насыщенные кремнеземом горные породы светлые (лейкократовые) и легкие (средняя плотность 2,65; содержание Fe2O3, FeO, MgO незначительно). Основные и ультраосновные горные породы темные (черные, меланократовые) и имеют плотность более 2,9, в их составе преобладают Fe2O3, FeO, MgO. В каждой группе выделяют магматические горные породы нормального (K2О+Na2О<Al2O3) и щелочного ряда (K2О+Na2О>Al2O3). Породы, различающиеся по содержанию главных оксидов, отличаются и по содержанию элементов примесей. С кислыми магматическими горными породами связаны руды олова, вольфрама, золота и т.д.; с основными породами руды меди и т.д.; с ультраосновными породами руды хрома, никеля, платина и т.д.; с щелочными породами руды титана, циркония, редких земель, апатиты и т. д. Магматические горные породы могут использоваться как минеральное сырье в цветной металлургии и химической промышленности (например, для получения алюминия и соды из нефелиновых сиенитов); как строительные материалы и как скальные основания зданий и сооружений.
При медленном застывании магмы и при метасоматозе на глубинах более 3 км образуются полнокристаллические крупно- и среднезернистые (средний размер зерен >10 мм и 1÷10 мм соответственно) массивные интрузивные горные породы, слагающие чаще всего секущие по отношению к вмещающей толще (дайки) и послойные (силлы) магматические тела. Структура магматитов может быть как равномерно-, так и неравномернозернистой. Из магмы, застывшей относительно быстро на глубине менее 1 км, или излившейся на земную поверхность, образуются эффузивные горные породы, залегающие в виде потоков и покровов. Эффузивные горные породы могут иметь текстуру со следами течения и состоят из вулканического стекла или скрытозернистой общей массы, часто включающей изолированные более крупные минеральные зерна. В термодинамических условиях земной коры на глубинах 1÷3 км из магмы возникают гипабиссальные породы, по строению занимающие промежуточное положение между интрузивными и эффузивными горными породами. Описано более 1000 магматических пород. Систематика магматических горных пород основана на их составе и строении. Наиболее распространенные магматические породы приведены в таблице 6. Множество горных пород, не указанных в таблице 6 являются переходными между породами смежных классов.
Осадочные горные породы образуются в результате процессов разрушения более древних горных пород любого генезиса, а также в процессе осаждения вещества из воды и
воздуха, жизнедеятельности организмов или совокупности этих процессов при поверхностном давлении и температуре.
Отложение исходного вещества осадочных горных пород происходит под действием силы тяжести обычно горизонтальными слоями. Смена условий осадконакопления часто приводит к стратификации (формированию отдельных слоев) осадочной толщи.
По способу образования осадочные горные породы делятся на хемогенные (гидрогенные), сложенные минералами, сформировавшимися химическим путем в водной среде; органогенные (биогенные, биохемогенные), сложенные фрагментами организмов и продуктами их преобразования и обломочные, состоящие из обломков горных пород (У. Твенгофел, 1926; М.С. Швецов, 1934). Породы близкие по составу и/или структуре могут принадлежать к разным генетическим классам (например, известняки могут быть, как хемогенными, так и органогенными, а пелиты хемогенными и обломочными).
Существуют и другие классификации осадочных пород. В 1998 г. В.Н. Швановым и др. предложена классификация осадочных горных пород по вещественно-структурному принципу на разряды кварцево-силикатных (силикалитов), несиликатных (оксидных, фосфатных, соляных и др.) и некарбонатно-углеродистых (органических) пород.
Наиболее характерными текстурами осадочных пород являются слоистая, землистая, оолитовая (с шарообразными выделениями в объеме породы), массивная; структуры – зернистая, скрытокристаллическая, обломочная, органогенная.
Таблица 6
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 636; Нарушение авторских прав?; Мы поможем в написании вашей работы!