
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Причины диссоциации. Сольватация и гидратация
Теплоты сольватации (гидратации)
Процесс электролитической диссоциации требует значительной затраты энергии. Происхождение этой энергии даже не рассматривалось в теории Аррениуса. По общепринятым сейчас представлениям, энергия, обеспечивающая появление ионов, выделяется в самом процессе электролитической диссоциации и представляет собой результат взаимодействия растворяемого вещества и растворителя. Благодаря этому взаимодействию образуются комплексы, содержащие молекулы растворителя – сольватированные (гидратированные) ионы. Энергетические эффекты, наблюдающиеся при этом, были названы, по предложению Фаянса (1915), энергиями сольватации (DGs) или, в водных средах, гидратации (DGг), а соответствующие тепловые эффекты – теплотами сольватации (– DНs = 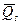 ) и гидратации (– DНг =
) и гидратации (– DНг = 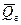 ).
).
Все вещества, образующие ионы при растворении, можно разбить на две группы в зависимости от их строения и природы связей. К первой из них относятся соединения, кристаллическая решетка которых построена из ионов, – ионофоры. Для таких веществ термин «электролитическая диссоциация» не очень удачен, так как в них и до процесса растворения не было молекул. Сольватация в этом случае является источником энергии не процесса диссоциации молекул, а процесса разрушения решетки с образованием свободных ионов. Поэтому в растворителях с высокой диэлектрической проницаемостью все ионофоры – сильные электролиты. К другой группе относятся молекулярные вещества – ионогены. Образование ионов при растворении ионогенов происходит лишь благодаря их химическому взаимодействию с растворителем. Энергия, необходимая для разрыва химической связи, компенсируется энергией связи протона с молекулой воды в ионе гидроксония (если один из ионов – ион водорода) и энергией гидратации ионов Н3О+ и А–. Ионогены в водных растворах – обычно слабые электролиты.
И для ионофоров, и для ионогенов конечными продуктами взаимодействия между растворяемым веществом и растворителем являются сольватированные ионы, а энергетические эффекты проявляются как энергии сольватации. Чтобы доказать это, надо рассчитать энергию сольватации и сопоставить ее с энергией кристаллической решетки (энергией химической связи). Если эти энергии окажутся близкими, то вывод о разрушении решетки соли (нейтральной молекулы ионогена) за счет ион-дипольного взаимодействия можно считать правильным.
Энергии и теплоты сольватации электролитов впервые были рассчитаны Борном и Габером (1919) при помощи циклов, основанных на законе Гесса.
NaCl (кр) 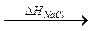 Na+(газ) + Cl–(газ)
Na+(газ) + Cl–(газ)



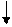 DHL DHs+ DHs–
DHL DHs+ DHs–
Na+ (aq) + Cl– (aq)
DHNaCl – изменение энтальпии в ходе разрушения кристаллической решетки хлорида натрия (связь с энергией решетки: DGp = DHNaCl – TDS; при 298К TDS составляет приблизительно 15 кДж/моль);
DHL – теплота растворения хлорида натрия, экстраполированная на бесконечно разбавленный раствор соли;
DHs+, DHs– – теплоты сольватации катиона и аниона.
Из этого цикла для теплоты сольватации хлорида натрия получаем:
DHsNaCl = DHs+ + DHs– = DHL – DHNaCl = 4 – 772 = – 768 кДж/моль.
Данное уравнение позволяет найти теплоту гидратации, если известны теплота растворения и энергия решетки. Теплоту растворения находят экспериментально, а энергии решеток рассчитывают либо по соответствующим уравнениям, либо из циклов, используя другие экспериментально определимые величины.
Как видно из расчета, теплота гидратации имеет тот же порядок, что и энергия решетки, и может обеспечить распад кристалла на отдельные ионы.
|
|
Дата добавления: 2014-01-07; Просмотров: 1728; Нарушение авторских прав?; Мы поможем в написании вашей работы!