
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модельные методы расчета энергии гидратации ионов
|
|
|
|
Энергия сольватации представляет собой выигрыш в энергии, который получается при перенесении моля ионов из вакуума в данный растворитель. При этом предполагается, что такой выигрыш в энергии не включает в себя электростатическое взаимодействие ионов. Чтобы избежать этого осложнения, раствор нужно поддерживать электронейтральным (вводить в него соответствующее количество ионов противоположного знака), а взаимное притяжение катионов и анионов элиминировать достаточным разбавлением раствора (теоретически бесконечным).
Рассмотрим расчет энергии и теплоты гидратации иона по методу непрерывной среды (модель Борна). Это наиболее простая модель для оценки энергии сольватации. Согласно этой модели, ион рассматривается как заряженный шарик радиуса ri, а растворитель – как сплошная однородная среда (континуум) с диэлектрической постоянной e.
При неизменной плотности заряда на пластинах плоского конденсатора напряженность поля между ними оказывается большей в вакууме ЕV, чем в диэлектрике ЕD. Отношение
ЕV / ЕD = e
называется диэлектрической проницаемостью вещества e при условии, что проницаемость для вакуума e о принята равной единице (e о = 8,85419×10–12 Ф/м = 8,85419 пФ/м).
Процесс переноса заряженного шарика из вакуума в среду разбивается на три этапа:
1. Разряд шарика в вакууме;
2. Перенос незаряженного шарика из вакуума в растворитель;
3. Заряжение шарика в среде.
При этом предполагается, что работа на втором этапе А2 = 0, а для расчета работы на этапах 1 и 3 используются основные законы электростатики. Так, согласно закону Кулона, сила, действующая на каждый из двух зарядов q1 и q2, находящихся в среде с диэлектрической постоянной e на расстоянии r, равна
F =  .
.
Поэтому напряженность поля Е, то есть сила, которая действует на заряд +1, находящийся в среде на расстоянии r от заряда q, составляет
Е = 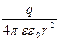 .
.
Поскольку напряженность поля связана с электрическим потенциалом j общей формулой Е = – dj / d r, то для потенциала на поверхности сферы радиуса ri получим
j = –  = –
= – 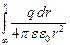 =
= 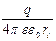 ,
,
где нижний предел интегрирования соответствует выбору нулевого потенциала на бесконечно большом расстоянии от рассматриваемой сферы. Из данного уравнения вытекает следующая формула для работы заряжения сферы:
А =  =
=  =
= 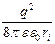 .
.
В соответствии с этой формулой для работ А1 и А3 получаем выражения
А1 =  и А3 = –
и А3 = –  ,
,
где zi e o – заряд иона.
Учитывая, что свободная энергия сольватации
– DGs = NA  ,
,
выводим основную формулу модели Борна:
– DGs = NA 
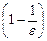 .
.
Таким образом, по теории Борна энергия сольватации иона определяется его зарядом и размерами, а также диэлектрической проницаемостью растворителя. Вышеприведенное уравнение можно применять к любым растворам, если известны их диэлектрические проницаемости.
Если воспользоваться уравнением Гиббса – Гельмгольца
DH = DG – T  ,
,
то можно получить также выражение для теплоты сольватации:
– DНs = NA 
 .
.
Вышеприведенное уравнение называют уравнением Борна – Бьеррума.
Качественно формула Борна правильно передает взаимную связь между энергиями (теплотами) сольватации и свойствами ионов. Так, в соответствии с опытом, теплоты гидратации растут с уменьшением радиуса иона и увеличением его заряда (см. выше), такой же вывод следует и из основной формулы модели Борна. Количественная проверка теории сольватации Борна (например, сравнение рассчитанных величин с величинами DНs(соли), полученными из цикла Борна – Габера) показывает, что рассчитанные величины значительно превышают соответствующие экспериментальные значения. Это указывает на весьма приближенный характер допущений, положенных в основу модели Борна. Для расчетов по формуле Борна необходимо знать диэлектрическую проницаемость растворителя и радиус иона. Радиусы ионов Борн принимал равными кристаллохимическим радиусам. Использование кристаллохимических радиусов вместо эффективных радиусов ионов в растворах приводит к ошибке при расчетах. Другая ошибка связана с отождествлением диэлектрической проницаемости раствора и чистого растворителя.
Были предприняты неоднократные попытки уточнить теорию сольватации Борна. Некоторые из них проводились в рамках все того же континуального подхода. Так, Уэбб несколько усовершенствовал формулу Борна, введя в нее поправки на уменьшение диэлектрической проницаемости раствора вблизи иона и на работу сжатия растворителя при введении электролита (явление электрострикции). Учет обоих эффектов приводит к тому, что величины энергий и теплот гидратации, вычисленные по формуле Борна – Уэбба, уменьшаются и приближаются к опытным. В теории Уэбба растворитель по-прежнему рассматривается как непрерывная среда и не учитывается ни строение его молекул, ни структура жидкости.
При рассмотрении процесса гидратации (сольватации) необходимо учитывать влияние каждого участника этого процесса, то есть и иона, и растворителя. Иными словами, достаточно полную картину процесса сольватации можно получить лишь тогда, когда будет выяснено, что делается с ионами при попадании их в растворитель и что происходит с растворителем в результате внесения в него ионов. Современный уровень разработки теории жидкого состояния не может дать полного и однозначного ответа на эти вопросы, хотя отдельные результаты в этом направлении уже получены. Протекание процесса сольватации определяется природой ионов (размер, заряд …), строением молекул жидкости и структурой ее в целом. Некоторые из этих факторов приняты во внимание в теории сольватации Борна – Уэбба, правда, только в виде первого приближения.
Бокрис и Конвей (1954) считают, что процесс сольватации проявляется по-разному в непосредственной близости от иона и в слоях растворителя, удаленных от него, то есть в ходе сольватации возникают как бы две сольватные оболочки – внутренняя и внешняя. Внутренняя сольватная оболочка состоит из молекул растворителя, прочно связанных с ионом и перемещающихся вместе с ним при его движении. Внешняя сольватная оболочка включает в себя все молекулы растворителя, состояние которых отличается от их состояния в исходном растворителе. В соответствии с этим различают первичную и вторичную энергии сольватации. Основной вклад в общую энергию сольватации дает энергия, отвечающая образованию внутренней сольватной оболочки.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1542; Нарушение авторских прав?; Мы поможем в написании вашей работы!