
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные растворы
|
|
|
|
Буферными растворами называются растворы с устойчивой активностью водородных ионов, то есть с определенным значением рН, которое практически не зависит от разбавления раствора и слабо меняется при прибавлении к раствору сильной кислоты или сильного основания - эта способность и называется буферностью.
Обычно буферные растворы представляют собой растворы, содержащие слабую кислоту (или основание) вместе с ее солью. Пример - смесь уксусной кислоты и ацетата Na. В растворе имеется сопряженная пара - СН3СООН и СН3СОО–, действие которой состоит в том, что при добавлении сильной кислоты ее протоны связываются основанием СН3СОО–, а при введении сильного основания уксусная кислота отдает ему свои протоны, и в обоих случаях [Н+] изменяется незначительно.
Найдем количественную связь между значением рН и активностями (в случае разбавленных растворов - концентрациями) растворенных веществ:
Кд,к = 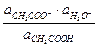 ;
; 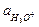 = Кд,к
= Кд,к  .
.
Если к раствору слабой кислоты добавлена соль этой кислоты и сильного основания, то диссоциация кислоты подавляется, и  равна общей активности кислоты ак (в растворе смеси уксусной кислоты и ацетата натрия), а
равна общей активности кислоты ак (в растворе смеси уксусной кислоты и ацетата натрия), а 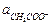 можно считать равной активности ацетата натрия ас:
можно считать равной активности ацетата натрия ас:
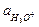 = Кд,к
= Кд,к  .
.
Подбирая различные отношения концентраций кислоты и соли, можно получить растворы с различными значениями рН. При данном составе раствора значение рН мало зависит от Т.
Другой пример буферного раствора - слабое основание NH4OH и его соль с сильной кислотой NH4Cl. Для этой сопряженной пары получим
Кд,о =  =
= 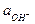
 ;
;
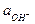 = Кд,о
= Кд,о 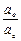 ;
; 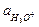 =
= 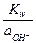 =
= 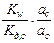 .
.
Анализ уравнений показывает, почему разбавление буферных растворов практически не меняет рН растворов: рН зависит не от абсолютных значений концентраций кислоты и ее соли, а от их соотношения.
Количественной характеристикой буферности является буферная емкость - число эквивалентов щелочи или кислоты, необходимое для изменения рН на единицу:
b¢ =  .
.
Величина b¢ зависит от Кд,к (Кд,о) и максимальна в области рН, близкой к р К. Буферные емкости одного и того же раствора относительно кислоты и щелочи различны.
Буферные смеси можно приготовить не только из кислоты (или основания) и соли, но и из двух солей на разных ступенях диссоциации (Na2HPO4 и NaH2PO4).
Буферные смеси находят применение при измерениях рН растворов, для проведения химических процессов в условиях постоянства рН.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 421; Нарушение авторских прав?; Мы поможем в написании вашей работы!