
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория замедленного разряда
|
|
|
|
Согласно этой теории наиболее медленной стадией сложного электрохимического процесса является процесс разряда ионов. Эта теория привлекла должное внимание лишь после работ Эрдей-Груза и Фольмера (1930), предположивших, что разряд ионов требует значительной энергии активации и поэтому может происходить с малой скоростью. Фольмеру удалось вывести уравнение Тафеля. Рассмотрим этот вывод.
Применим к электрическому процессу обычное уравнение для скорости химического процесса:
v = k ¢ [Н3О]+ е – Е/RT,
где Е – энергия активации процесса. Так как скорость электрохимического процесса определяется силой тока
v = 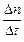 =
=  ,
,
то для силы тока можно написать
I = zF k ¢ [Н3О]+ е – Е/RT = k ¢¢ [Н3О]+ е – Е/RT.
Для раствора постоянного состава получим
I = k е – Е/RT.
Роль перенапряжения сводится к снижению энергии активации, и величина этого снижения пропорциональна перенапряжению. Положим его равным aFh (a – коэффициент пропорциональности), тогда
Е = Ео – aFh,
где Ео – энергия активации неполяризованного электрода. Таким образом, при наличии перенапряжения
I = k 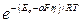 ; I = k
; I = k 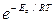 e aFh /RT = k 1 e aFh /RT.
e aFh /RT = k 1 e aFh /RT.
Логарифмируя, получим
ln I = ln k 1 + 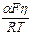 .
.
Решив уравнение относительно h, получим
h = 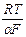 ln I –
ln I – 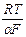 ln k 1.
ln k 1.
От силы тока I переходим к плотности тока, подставив I = i s. Полагая s постоянной, переходя к десятичным логарифмам и обозначая сумму постоянных при данной температуре слагаемых через а, получим формулу Тафеля
h = а + 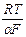 ln i = a +
ln i = a +  lg i.
lg i.
Если a = 0,5, то b = 0,058/a = 0,116. Достоинством теории медленного разряда является то, что она приводит к правильной величине коэффициента b.
Теория медленного разряда в том виде, в каком она была изложена Фольмером, не учитывала строения границы раздела электрод – раствор, потому не могла объяснить влияния состава электролита на величину h. Влияние строения ДЭС на кинетику электрохимических реакций впервые было принято во внимание А.Н.Фрумкиным. Это позволило объяснить большое количество экспериментальных данных о влиянии состава раствора на величину h, а также на кинетику других электродных процессов, в частности, на кинетику реакций электровосстановления анионов.
Ни рекомбинационная теория водородного перенапряжения, ни теория замедленного разряда не являются всеобщими. К металлам с большим перенапряжением (малой энергией адсорбции водорода) – Hg, Pb – применима теория замедленного разряда, которая объясняет большинство явлений, связанных с изменением h. К металлам с малым перенапряжением (большой энергией адсорбции водорода) – Pt – наиболее применима теория рекомбинации.
Возникновение перенапряжения – общее явление для электрохимических процессов. Значительные перенапряжения возникают при электролитическом выделении не только водорода, но и других газов, а также некоторых металлов.
Перенапряжение является проблемой, имеющей не только теоретическое, но и важнейшее практическое значение. Наличие перенапряжения приводит к тому, что при промышленном электролизе непроизводительно затрачиваются значительные количества электрической энергии. Следовательно, снижение перенапряжения на электроде – одна из важнейших задач прикладной электрохимии. Решить эту задачу невозможно без установления истинного механизма электрохимического процесса, без установления его лимитирующей стадии. Поэтому задача электрохимической кинетики заключается в нахождении способов увеличения скорости наиболее медленной стадии.
Лекция 61
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 388; Нарушение авторских прав?; Мы поможем в написании вашей работы!