
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Число формульных единиц
|
|
|
|
Координационное число, координационный полиэдр,
Зная модель кристаллической структуры, т. е. пространственное расположение атомов относительно элементов симметрии в элементарной ячейке — их координаты, а, следовательно, и характеристики правильных систем точек, которые занимают атомы, можно сделать ряд кристаллохимических выводов, используя достаточно простые приемы описания структур. Поскольку 14 выведенных решеток Браве не могут отразить все многообразие известных к настоящему времени кристаллических структур, необходимы характеристики, позволяющие однозначно описать индивидуальные особенности каждой кристаллической структуры. К таким характеристикам, дающим представление о геометрическом характере структуры, относятся: координационные числа (КЧ), координационные многогранники (КМ), или полиэдры (КП), и число формульных единиц (Z). Прежде всего по модели можно решить вопрос о типе химической формулы рассматриваемого соединения, т. е. установить количественное соотношение атомов в структуре. Это нетрудно сделать на основе анализа взаимного окружения — взаимной координации — атомов разных (или одинаковых) элементов.
Термин «координация атома» был введен в химии в конце XIX в. в процессе формирования ее новой области — химии координационных (комплексных) соединений. И уже в 1893 г. А. Вернер ввел понятие координационное число (КЧ) как число атомов (лигандов - ионы, непосредственно связанные с центральными атомами (катионами)), непосредственно связанных с центральным. Химики в свое время столкнулись с тем фактом, что число связей, образуемых атомом, может отличаться от его формальной валентности и даже превышать ее. Например, в ионном соединении NaCl каждый ион окружен шестью ионами противоположного заряда (KЧNa/Cl = 6, KЧCl/Na = 6), хотя формальная валентность атомов Na и С1 равна 1. Таким образом, согласно современному представлению, КЧ — это число ближайших к данному атому (иону) соседних атомов (ионов) в структуре кристалла независимо от того, являются они атомами того же сорта, что и центральный, или иного. При этом межатомные расстояния являются основным критерием, используемым при подсчете КЧ.
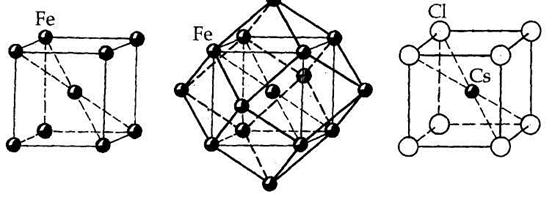
Например, в кубических структурах модификации a-Fe (рис. 7.2.а) и CsCl (рис. 7.2. в) координационные числа всех атомов равны 8: в структуре a-Fe атомы Fe располагаются в узлах объемноцентрированного куба, отсюда KЧFe= 8; в структуре CsCl в вершинах элементарной ячейки располагаются ионы Сl-, а в центре объема — ион Cs+, координационное число которого тоже равно 8 (КЧ Cs/Cl = 8), так же как и каждый ион Cl окружен восемью ионами Cs+ по кубу (КЧ Cl/Cs = 8). Это подтверждает отношение Cs: С1 = 1: 1 в структуре этого соединения.
| ||
| а | б | в |
| Рис. 7.2. Кристаллические структуры α-Fe (а и б) и CsCl (в). |
В структуре α –Fe координационное число атома Fe по первой координационной сфере равно 8, с учетом второй сферы — 14 (8 + 6). Координационные полиэдры — соответственно куб и ромбододекаэдр.
Координационные числа и координационные многогранники являются важнейшими характеристиками конкретной кристаллической структуры, отличающими ее от остальных структур. На этой основе можно проводить классификацию, относя конкретную кристаллическую структуру к определенному структурному типу.
Установить тип химической формулы по структурным данным (т. е. по модели структуры или по ее проекции — чертежу) можно и иным путем, подсчитав число атомов каждого сорта (химического элемента), приходящихся на одну элементарную ячейку. Это подтверждает тип химической формулы NaCl.
|
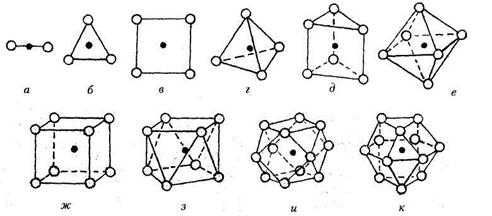
| Рис. 7.3. Некоторые координационные полиэдры, встречающиеся в кристаллических структурах: а - гантель (КЧ = 2); б - треугольник (КЧ = 3); в - квадрат (КЧ = 4); г - тетраэдр (КЧ = 4); д - тригональная призма (КЧ = 6); е - октаэдр (КЧ = 6); ж — куб (КЧ = 8); з — томсоновский куб (КЧ = 8); и — архимедов кубооктаэдр (КЧ = 12); к — гексагональный аналог кубооктаэдра (КЧ =12) |
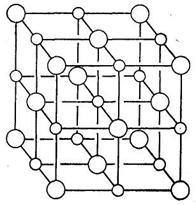
В структуре NаС1 (рис. 7.4), типичной для ионных кристаллов типа АВ (где А—атомы (ионы) одного сорта, В—другого), в построении элементарной ячейки принимают участие 27 атомов обоих сортов, из них 14 атомов А (шары большого размера) и 13 атомов В (меньшие шары), но полностью входит в ячейку лишь один. атом, находящийся в ее центре. Атом, находящийся в центре грани элементарной ячейки, принадлежит одновременно двум ячейкам—данной и смежной с ней. Поэтому данной ячейке принадлежит лишь половина этого атома. В каждой из вершин ячейки сходится одновременно по 8 ячеек, поэтому данной ячейке принадлежит лишь 1/8 атома, расположенного в вершине. От каждого атома, находящегося на ребре ячейки, ей принадлежит лишь 1/4.
Вычислим общее число атомов, приходящихся на одну элементарную ячейку NаС1:
| Положение атома | Объем входящих в ячейку | Число атомов | Всего в ячейку приходится |
| В вершине В середине ребра В центре грани В центре ячейки | 1/8 1/4 1/2 |
Итак, на долю ячейки, показанной на рис. 7.4, приходится не 27 атомов, а всего 8 атомов: 4 атома натрия и 4 атома хлора.
|
 - Cl - Cl  - Na - Na
|
| Рис.7.4 Структура каменной соли |
Определение числа атомов в ячейке Браве позволяет кроме типа химической формулы получить еще одну полезную константу — число формульных единиц, обозначаемое буквой Z. Для простых веществ, состоящих из атомов одного элемента (Сu, Fe, Se и др.), число формульных единиц соответствует числу атомов в элементарной ячейке. Для простых молекулярных веществ (I2, S8 и т. д.) и молекулярных соединений (СО2) число Z paвно числу молекул в ячейке. В подавляющем же большинстве неорганических и интерметаллических соединений (NaCl, CaF2, СuАu и т. д.) молекул нет, и в этом случае вместо термина «количество молекул» используют термин «число формульных единиц».
Число формульных единиц можно определить экспериментально в процессе рентгеновского исследования вещества.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5612; Нарушение авторских прав?; Мы поможем в написании вашей работы!