
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимые ингибиторы
|
|
|
|
Ингибиторы ферментов
Скорость ферментативных реакций может быть частично снижена или полностью заблокирована определенными веществами, так называемыми ингибиторами ферментов. Некоторые ингибиторы ферментов являются для организма животных и человека эффективными лекарственными веществами, другие — смертельными ядами.
Различают три типа обратимого ингибирования ферментов: конкурентное, неконкурентное и бесконкурентное.
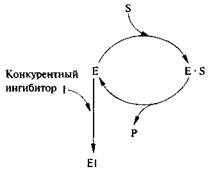
Конкурентным называют ингибитор, обратимо взаимодействующий с активным центром фермента. Как правило, конкурентные ингибиторы по структуре похожи на субстрат и могут вытесняться из фермент-ингибиторного комплекса избытком субстрата. Взаимодействие с конкурентным ингибитором не приводит к денатурации или инактивации фермента, поэтому при замене ингибитора на субстрат скорость ферментативной реакции не снижается (рис. 6.10).
При взаимодействии фермента с конкурентным ингибитором изменяется значение Ки соответствующей ферментативной реакции.
Сходство субстрата и конкурентного ингибитора достаточно для взаимодействия и образования фермент-ингибиторного комплекса, но недостаточно для ферментативной реакции. В качестве примера можно привести действие малоновой кислоты на реакцию, которая катализируется сукцинатдегидроге-назой и связана с превращением янтарной кислоты в фумаровую.

|
|
Рис. 6.10. Схема действия конкурентного ингибитора
Добавление малоновой кислоты к реакционной смеси снижает или полностью останавливает ферментативную реакцию, так как она является конкурентным ингибитором сукцинатдегидрогеназы.
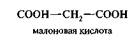
Сходства малоновой кислоты с янтарной достаточно для образования комплекса с ферментом, однако распад этого комплекса не происходит. При увеличении концентрации янтарной кислоты она вытесняет малоновую кислоту из комплекса, в результате активность сукцинатдегидрогеназы восстанавливается.
Многие лекарственные вещества ингибируют ферменты человека и животных по конкурентному типу. Примером могут служить сульфамидные препараты, по структуре сходные с я-аминобензойной кислотой (ПАБК). Это соединение в микробных клетках является интермедиантом фолиевой кислоты — важного компонента нуклеинового обмена. При введении сульфамидных препаратов в организм происходит ингибирование ферментов метаболизма ПАБК, что приводит к снижению синтеза нуклеиновых кислот и гибели микроорганизма.
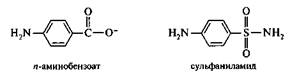
В данном случае сульфаниламид является конкурентным ингибитором фермента синтеза фолиевой кислоты.
В структуру пептогликана клеточной стенки бактерий включен D-аланин, отсутствующий в организме животных и человека. Для синтеза клеточной стенки бактерии при помощи фермента аланин-рацемазы превращают животный L-аланин в D-форму. Аланин-рацемаза характерна для бактерий и не обнаружена у млекопитающих. Следовательно, она представляет хорошую мишень для ингибирования лекарственными препаратами. Замещение одного из протонов метильной группы на фтор дает фтораланин, с которым связывается аланин-рацемаза, что приводит к ее ингибированию.
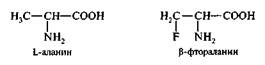
Таким образом, можно конструировать лекарственные вещества, ингиби-рующие ферменты по конкурентному типу. Чтобы быть эффективным, ингибитор должен иметь высокое сродство к ферменту. В противном случае необходимо назначать большие дозы лекарственных препаратов, чтобы активно конкурировать с эндогенным субстратом за активный центр фермента.
Неконкурентные ингибиторы взаимодействуют с ферментами не в области активного центра, а на каком-то от него удалении, причем никаким избытком субстрата из комплекса не удаляются. При взаимодействии ингибитора с ферментом происходит изменение его конформации с последующей частичной дезинтеграцией активного центра. При взаимодействии фермента с неконкурентным ингибитором изменяется Vmax ферментативной реакции.
Бесконкурентное ингибирование имеет место, когда ингибитор взаимодействует с ферментом только в составе фермент-субстратного комплекса, препятствуя его распаду. Примером необратимого действия ингибиторов на ферменты могут служить фосфорорганические вещества, применяемые в качестве инсектицидов.
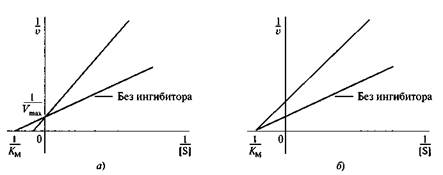
Рис. 6.11. График Лайнуивера—Бэрка для идентификации различных типов ингибирования: а — конкурентное ингибирование; б— неконкурентное ингибирование
Тип ингибирования можно определять графически, используя методы Лайнуивера—Бэрка или Эди—Хофсти (рис. 6.11).
Как видно из рис. 6.11, влияние конкурентного ингибитора на скорость реакции приводит к изменению Км, максимальная скорость реакции при этом остается без изменения. Неконкурентное ингибирование связано со снижением Vmax, без изменения константы Мехаэлиса.
Активность многих ферментов тормозится избытком субстрата, причем имеется несколько механизмов этого процесса.
• Если в образовании фермент-субстратного комплекса участвует несколько функциональных групп фермента, то возможно одновременное присоединение к активному центру двух или более субстратов, что однозначно приведет к образованию неактивного комплекса.
• В случае избытка субстрата возможно его присоединение не только к активному центру, но и к другим химическим группировкам, функционально связанным с активным центром. Такого рода взаимодействие может помешать ферментативной реакции.
• Увеличение концентрации субстрата может повысить ионную силу реакционной среды и, как следствие, затормозить скорость ферментативной реакции.
Торможение продуктами реакции связано с тем, что они могут связываться с ферментом или с каким-либо другим компонентом системы таким образом, что скорость прямой реакции снижается.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1131; Нарушение авторских прав?; Мы поможем в написании вашей работы!