
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особенности восстановления оксидов железа водородом
|
|
|
|
Восстановление оксидов железа водородом протекает также по двум схемам: в две стадии при температурах ниже 570 ОС и в три стадии при температурах выше 570 ОС.
Реакции восстановления оксидов железа водородом подобны реакциям восстановления окисью углерода:
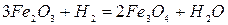 -12,.5 кДж/кг Fe (2.1‑9)
-12,.5 кДж/кг Fe (2.1‑9)
 -867 кДж/кг Fe при t<570OC (2.1‑10)
-867 кДж/кг Fe при t<570OC (2.1‑10)
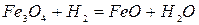 -372 кДж/кг Fe при t>570OC (2.1‑11)
-372 кДж/кг Fe при t>570OC (2.1‑11)
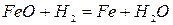 -497 кДж/кг Fe при t>570OC (2.1‑12)
-497 кДж/кг Fe при t>570OC (2.1‑12)
На рисунке приведена диаграмма равновесных газовых смесей Н2 и Н2Опар с окислами железа и железом.

Тепловые эффекты реакций отрицательные - все линии нисходящие.
Сравнивая условия термодинамического равновесия процессов восстановления железа монооксидом углерода и водородом, следует отметить:
При температуре 810 ОС в равновесных газовых фазах с Fe3O4, FeO и Fe устанавливается одинаковое соотношение газов - восстановителей и его окислов. То есть окись углерода и водород при температуре 810 ОС обладают одинаковым сродством к кислороду, одинакова их восстановительная способность.
При температурах ниже 810 ОС водород, как восстановитель, слабее монооксида углерода (для протекания восстановительного процесса при одних и тех же температурах доля водорода в газовой фазе должна быть выше, чем доля монооксида углерода).
При температурах выше 810 ОС водород становится более сильным восстановителем.
Водород восстанавливает окислы железа быстрее, чем монооксид углерода. Это объясняется тем, что молекулы водорода быстрее диффундируют к поверхности не восстановленного окисла (через слой продуктов восстановления и примыкающую к куску пленку газа) и лучше адсорбируется в ней, чем СО. Кроме того, образующиеся при восстановлении, пары воды реагируют с монооксидом углерода с образованием водорода:
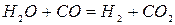 (2.1‑13)
(2.1‑13)
Образовавшийся водород может вновь принять участие в восстановлении. Таким образом, водород оказывается промежуточным реагентом, передающим кислород от окислов железа окиси углерода. Водород существенно ускоряет процесс косвенного восстановления.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1075; Нарушение авторских прав?; Мы поможем в написании вашей работы!