
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Интенсивность реактора
|
|
|
|

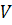 – объем реакционного пространства
– объем реакционного пространства
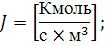
Интенсивность реактора 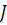 по сравнению с производительностью реактора
по сравнению с производительностью реактора 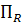 - является информационно емкой характеристикой оборудования, так как учитывает не только экстенсивный фактор (количество продукта в единицу времени), но и интенсивный фактор (количество вещества nR, образующегося в единицу времени в единице объема) – это аналог скорости реакции или процесса в целом.
- является информационно емкой характеристикой оборудования, так как учитывает не только экстенсивный фактор (количество продукта в единицу времени), но и интенсивный фактор (количество вещества nR, образующегося в единицу времени в единице объема) – это аналог скорости реакции или процесса в целом.
Выбор технологического режима. (ТР)
Технологический режим – это такая совокупность технологических параметров (Т,Р,С…), которая обеспечивает оптимальные условия эксплуатации технологического оборудования (реакционное оборудование).
1.а Выбор технологического режима на основании данных о химическом равновесии.
Химическое равновесие – раздел химической термодинамики.
Использование законов химического равновесия позволяют ответить на следующие основные вопросы, стоящие перед разработчиком реакционной аппаратуры:
1. Возможность самопроизвольного протекания процесса слева направо.
2. Каков возможный состав реакционной смеси в момент равновесия.
3. Определение или оценка тепловых эффектов  ; физических превращений: пар
; физических превращений: пар 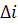 .
.
Рассмотрим 1 пункт оценка самопроизвольного протекания процесса – используют величину свободной энергии Гиббса: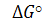 (кДж/кмоль)
(кДж/кмоль)

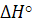 - тепловой эффект
- тепловой эффект
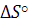 - изменение энтропии
- изменение энтропии
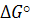 < 0 реакция протекает слева направо, самопроизвольные реакции.
< 0 реакция протекает слева направо, самопроизвольные реакции.
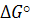 > 0 реакция не может протекать самопроизвольно слева направо.
> 0 реакция не может протекать самопроизвольно слева направо.
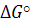 = 0 состояние химического равновесия
= 0 состояние химического равновесия
Для реакции:
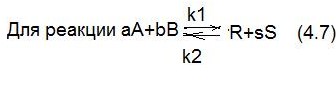
В случае наступления момента химического равновесия скорость прямой и обратной реакции равны.

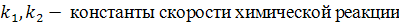
Тогда скорость прямой и обратной реакции:
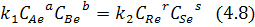
Проведем тождественное преобразование:

Из закона действующих масс:
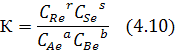
Константа равновесия характеризует состав реакционной смеси в момент равновесия:
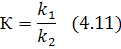
Константа равновесия определяется частным от деления произведения концентрации продуктов реакции (в соответствующих степенях) численно равных соответствующим значениям стехиометрических коэффициентов на произведение концентрации исходных реагентов в момент равновесия и возведенных в соответствующие степени.
Выражение константы равновесия через парциальные давления 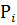 . Для перехода от
. Для перехода от 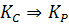 (для газовых реакций) используют закон Дальтона:
(для газовых реакций) используют закон Дальтона:

∑Pi=P
P – общее давление;
m – мольная доля.
Для реакции синтеза аммиака (1.1):


Связь константы равновесия с температурой.
Какой состав реакционной смеси следует ожидать на выходе из реакции.

Кр связана с величиной ΔG по уравнению изотермы Вант-Гоффа.
по уравнению изотермы Вант-Гоффа.
Пример 4.2
Определить константу равновесия при температуре 700 К реакции синтеза аммиака (1.1), протекающей в колонне синтеза (2.2), если
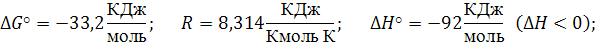
Уравнение изобар Ван-Гоффа:

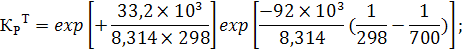

С ростом температуры константа равновесия резко падает, так как химическое равновесие смещается влево; без катализатора такая реакция не осуществима в практических условиях.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1284; Нарушение авторских прав?; Мы поможем в написании вашей работы!